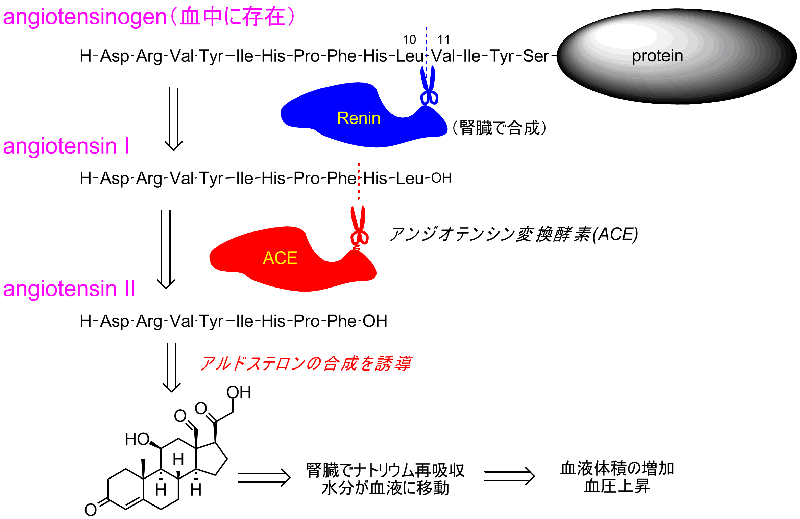
血圧とレニンアン-ジオテンシン-アルドステロン系の関係はすでに述べました。
アンジオテンシンIに重要な生理活性は見られませんが、アンジオテンシン変換酵素(ACE)によって、さらにC側から二つのペプチドが切り離され、アンジオテンシンIIが生成します。
アンジオテンシンIIはアルドステロンの生合成を加速し、アルドステロンは腎臓でナトリウムイオンの再吸収を促進する効果があるため、同時に水分も吸収され、体液(血液)量が増加、即ち血圧が増加します。
ACE阻害剤
血圧とレニンアン-ジオテンシン-アルドステロン系の関係はすでに述べました。
アンジオテンシンIに重要な生理活性は見られませんが、アンジオテンシン変換酵素(ACE)によって、さらにC側から二つのペプチドが切り離され、アンジオテンシンIIが生成します。
アンジオテンシンIIはアルドステロンの生合成を加速し、アルドステロンは腎臓でナトリウムイオンの再吸収を促進する効果があるため、同時に水分も吸収され、体液(血液)量が増加、即ち血圧が増加します。

従ってアンジオテンシン変換酵素を阻害しても血圧上昇要因の濃度は低く保たれるはずです。
しかし、発想はよくても大きな問題点がありました。当時はアンジオテンシン変換酵素(angiotensin converting enzyme:
ACE)の結晶化には成功していなかったのです。そこで科学者はカルボキシペプチダーゼAと機能が類似していることに注目し、構造的類推からACE阻害剤を開発したそうです。現在はACEの結晶解析ができていますので、比較してみますと、反応部位に亜鉛イオンが共通していることは判りますが、共通点はほとんど見えません。タンパク質のサイズも大きく異なります。
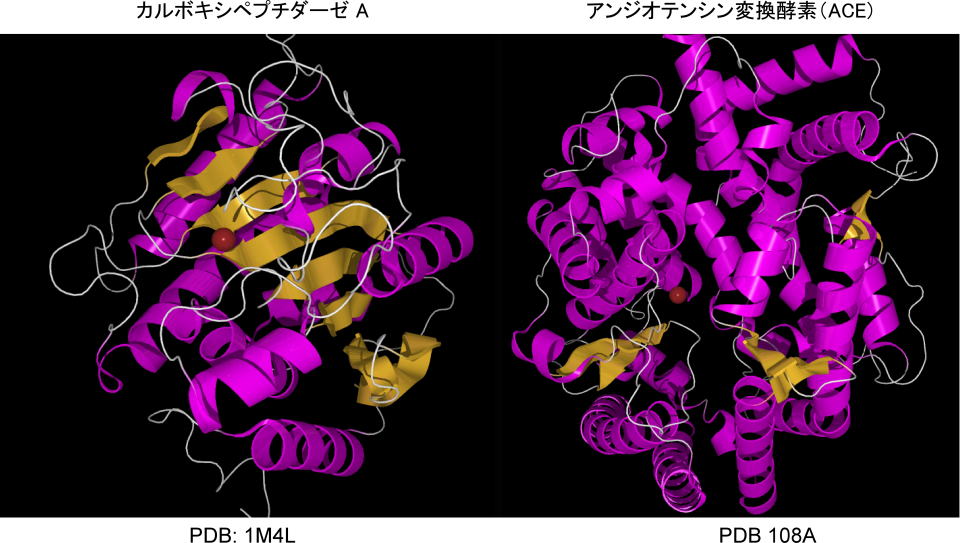
彼らは反応機構から、その類似性を考察していきました。
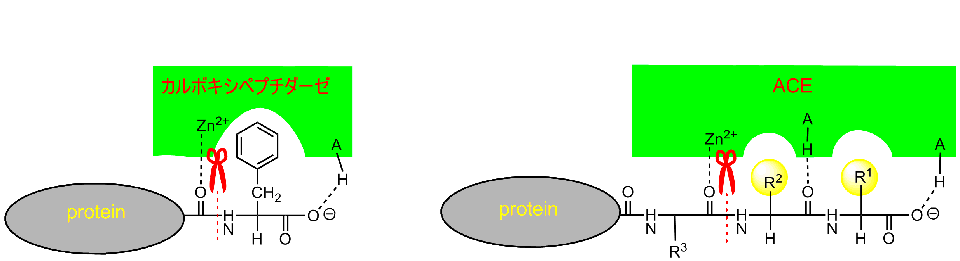
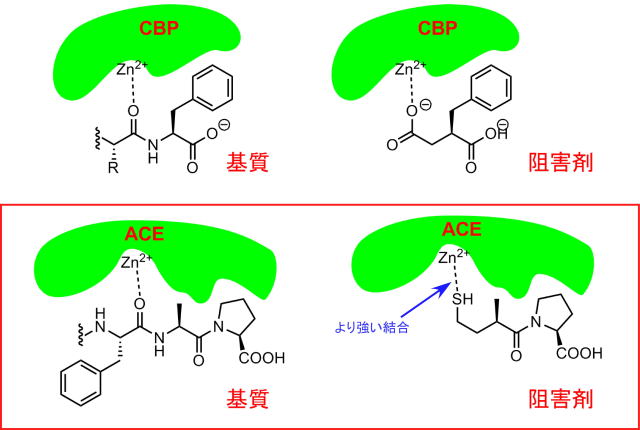
カルボキシペプチダーゼはC末端のフェニルアラニンを認識してそのN側を亜鉛イオンを利用して加水分解しているのに対して、ACEではC末端のロイシン、ヒスチジンを認識して亜鉛イオンを利用して加水分解します。
共通点は亜鉛イオンだけにも見えてしまいます。
ベンジルコハク酸はカルボキシペプチダーゼの阻害剤になります。
また、ヘビ毒から見つかったペプチドのうち-Phe-Ala-Proといった配列はACEの基質になることが判りました。
この二つを組み合わせてカプトプリルのデザインがされたそうです。
即ち、ベンジルコハク酸は、C末端のフェニルアラニンの窒素原子を炭素原子で置き換えたアナログで、ペプチド結合は無いので、反応せず長時間酵素の反応部位に滞在してしまうことで酵素を阻害します。
このとき、N側にアミノ酸を持つ必要がありません。
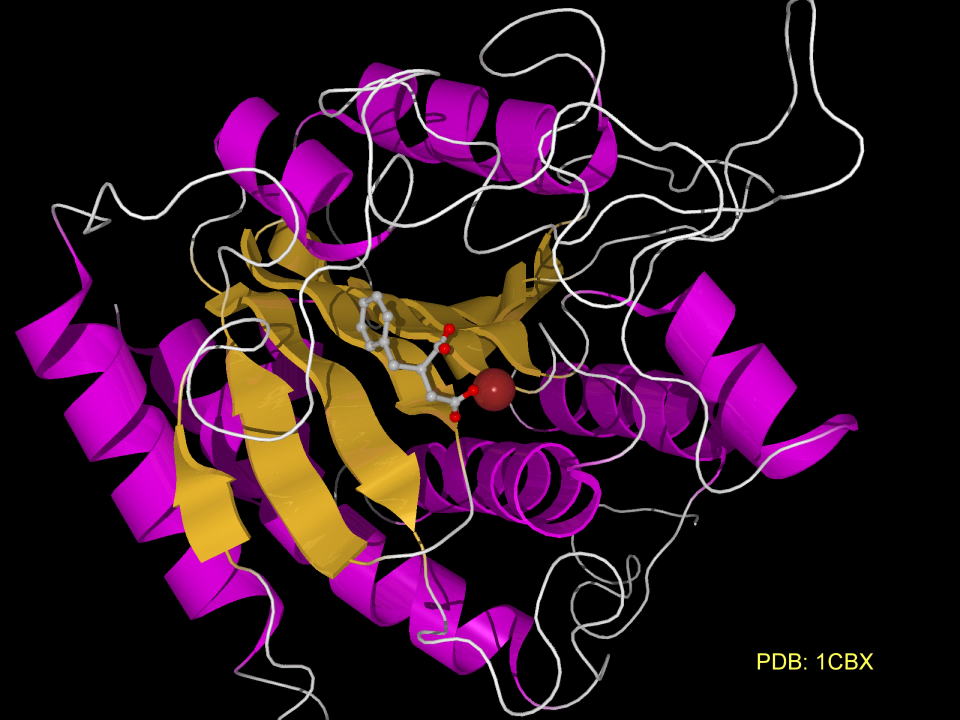
一方ヘビ毒から、アラニループロリンが基質になることを考えると、ベンジルコハク酸のように窒素原子を炭素原子に置き換える手法が効果的ということになります。下にカルボキシペプチダーゼに取り込まれたベンジルコハク酸の様子です。
ベンジルコハク酸は亜鉛イオンにトラップされています。
亜鉛イオンが活性中心ということを考慮してカルボン酸部分をチオールと変えればより強い結合が期待できるという訳です。
硫黄-亜鉛の結合が強いことは、硫化亜鉛の溶解度積([Zn2+][S] = 1.0×10-25 mol2/L2)からも明白です。
このようにしてカプトプリルは誕生しました。
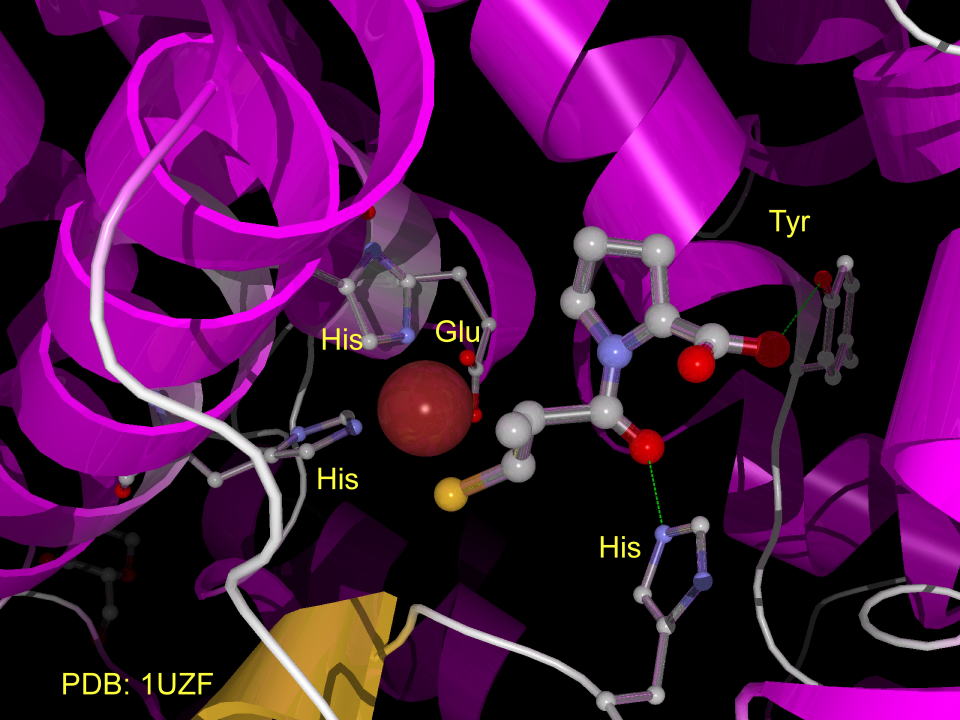
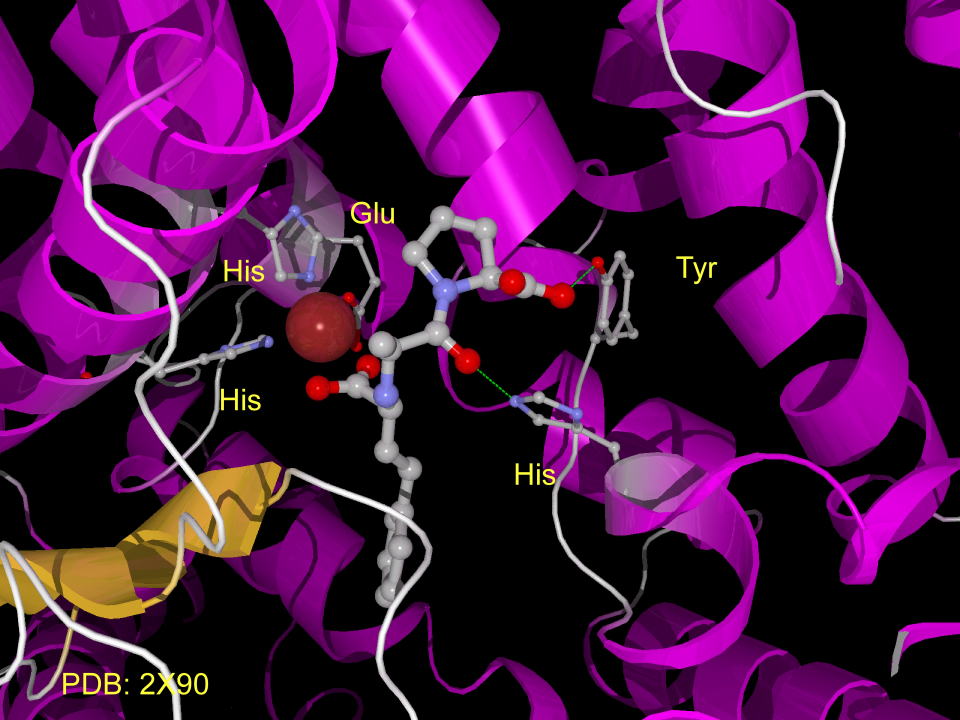
下にACEを阻害するカプトプリルの様子を示します。
亜鉛イオンは、二つのヒスチジン、およびグルタミン酸によって固定され、、カプトプリルの水酸基はヒスチジン、カルボニルはチロシンによって水素結合でよってひきつけられています。(図には水素はありません。実際には水素原子を介しての水素結合です。)
3D図を示しました。(MolFeatプラグインが必要です)
(回転:左ボタンを押してドラッグ、拡大縮小:右ボタンを押してドラッグ)
医薬品チオール官能基を用いるのは冒険です。
チオール基は酸化反応に弱く、肝臓で酸化されてしまう可能性があります。
いわゆるバイオアベイラビリティ―が問題になります。
そこでチオール基を持たないACEも開発されました。
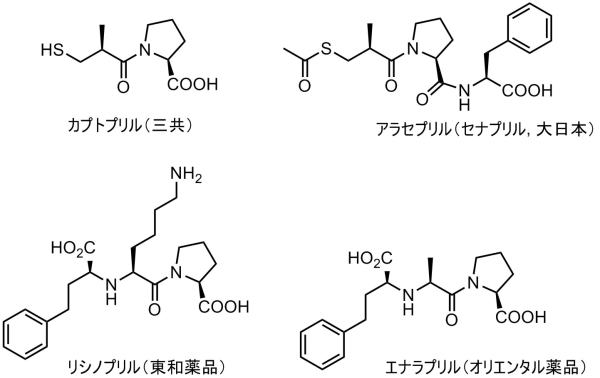
リシノプリルとACEとの複合体です。
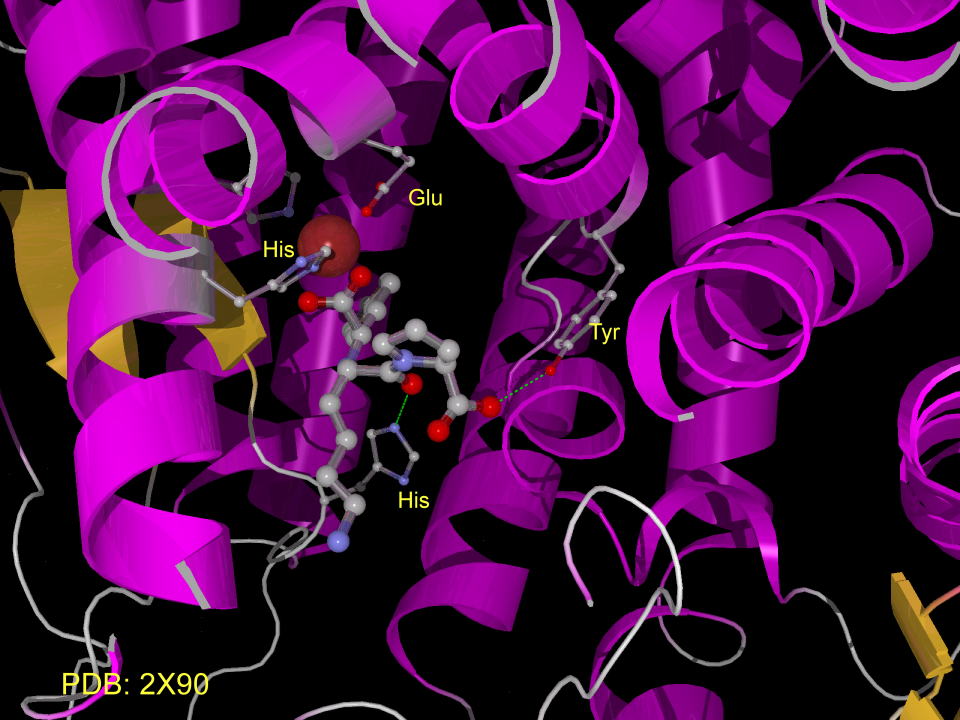
エナラプリルとACEとの複合体です。
ACE阻害剤の売り上げは年間1500億円を超える規模になっています。