ノイラミニダーゼ阻害剤はインフルエンザ治療に一般的に用いられるようになってきました。
しかし、タミフルの場合、B型インフルエンザには効きが悪く、また最近ではタミフル耐性ウィルスも報告されるようになりました。
一方リレンザの場合、耐性ウィルスは発生しにくいようですが、一日2回、5日間投与を続ける必要があるなど、より優れたノイラミニダーゼ阻害剤の開発がおこなわれてきました。
2010年、第一三共から新しいインフルエンザ治療薬イナビルが上市されました。
イナビルは、通常一回の吸入で治療が完了するという画期的なお薬です。
さらに、タミフル耐性ウィルスにも効果的とのことです。
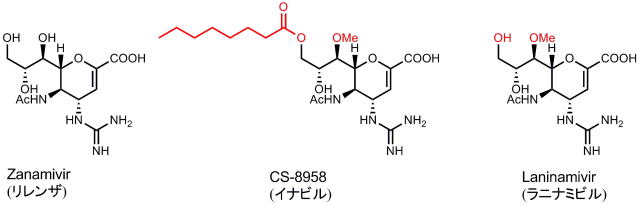
構造をよく見てみると、リレンザそっくりな構造にオクタン酸がエステルとして結合しています。
オクタン酸エステル部分は、体内への吸収に有利に働くそうです。体内でオクタン酸エステル部分は徐々に加水分解され、真の活性体ラニナミビルに変換されるとのこと、つまりイナビルはラニナミビルのプロドラッグということになります。
ラニナミビルとリレンザではメチル基が一か所ついているかどうかの違いです。
徐々に活性型のラニナミビルに変換されるため、これの体内での濃度が長時間維持されるとため、一回の投与で済むわけです。
実際には、病院で処方箋をもらってそのまま薬局で吸引しておしまいという形みたいです。
そのためか、投与量はリレンザより多くなり、(大人の場合)リレンザの場合10mgを1日2回5日間に対し、イナビルは一回に40mg投与します。
それでも絶対量はリレンザの半分以下で、おそらくその理由はバイオアベイラビリティーの高さです。
Protein Data Bankを探してみると、ラニナミビルとノイラミニダーゼとの複合体も見つかりました。(Gao G. F. et al., Plos Pathog.7: e1002249-e1002249, 2011 )
タミフル、リレンザともほぼ同じようなノイラミン酸のミミックとしての結合様式で、ノイラミニダーゼを阻害しています。
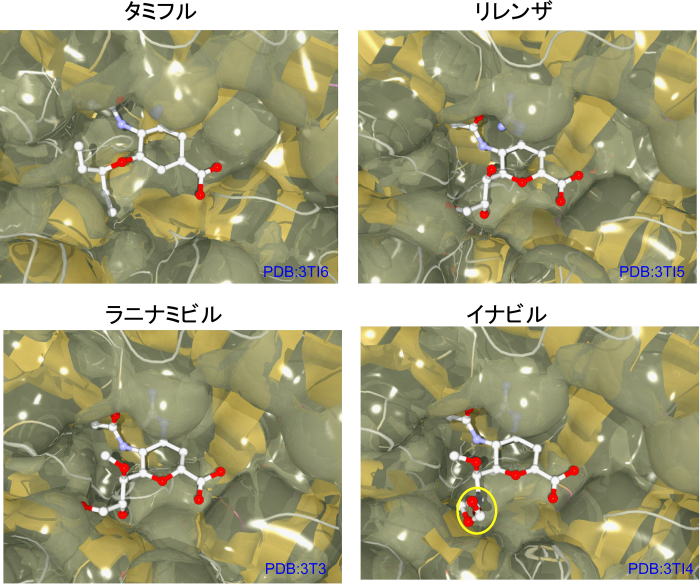
なるほどと、論文を眺めていて、イナビルって標的タンパクと共結晶作っても意味がないのではと感じます。
何故ならイナビルはラニナミビルのプロドラックであるため、オクタン酸エステル部分が加水分解されて活性が出ることになっているからです。
複合体(PDB:3TI4)の阻害剤部分を抽出してみました。
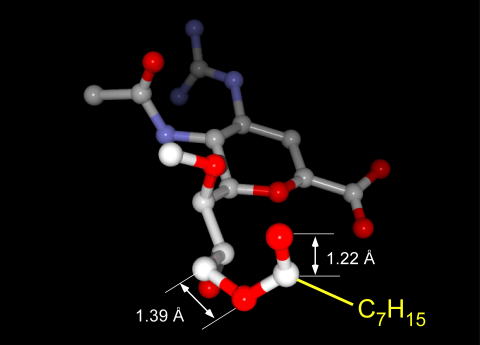
ラニナミビルにヒドロキシメチル基が結合しているようにも見えます。
仮にヒドロキシメチル基とした場合、アセタールが結合したことになります。
化学を勉強した人には当たり前ですが、アセタールは通常非常に不安定でこのような共結晶を作る作業中で壊れてしまうはずです。
というのか、その材料となるホルムアルデヒドは添加していないはずです。
長さを測定してみると、末端のC-O結合は1.22Åと通常のC-O結合(約1.38Å)と比べて有意に短くなっています。
つまり、これは普通のC-O結合ではなく、カルボニル(C=O)結合だからです。オクタン酸エステル部分はまだ結合したままなのです。
生体内ではこのエステル部分は加水分解されますが、共結晶化の条件ではそのようなことは起こらなくて当然です。
残りのヘキシル基部分は、結晶中でも運動が速く、電子密度が分散してしまった(写真で言うとブレて見えなかった)ということのようです。
論文の著者は言及していませんが、プロドラッグの状態でもノイラミニダーゼ活性が強いということなのでしょうか?