プロスタグランジンとアスピリン
体調が悪くて頭痛に苦しめられることがありますが、頭の中での毛細血管が収縮して、血圧が上がることが要因です。
何故、血管が収縮するかというと、ホスホリパーゼという酵素により炎症等により細胞膜からその構成成分のアラキドン酸が遊離します。
このアラキドン酸がシクロオキシゲナーゼによりプロスタグランジンというオータコイドが生成します。
プラスタグランジンには複数の誘導体があり、その機能も様々ですが、生成したプロスタグランジンは血管収縮を引き起こし、痛みとなるわけです。
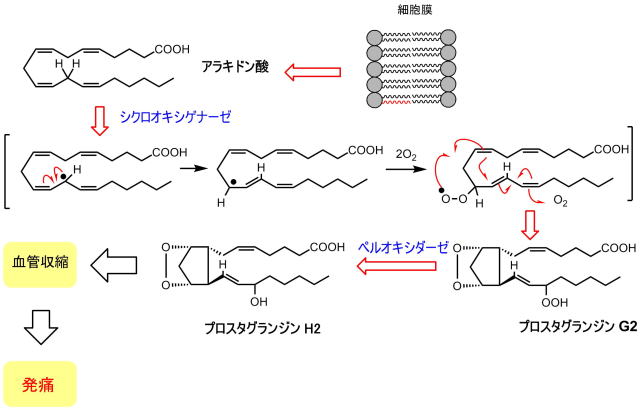
図でも解るように、プロスタグランジンの生成にはシクロオキシゲナーゼという酵素が関与しています。
シクロオキシゲナーゼは、アラキドン酸を反応に有利な立体配座に固定し、ラジカル反応を開始させるという二つの機能を持ち合わせていることになります。
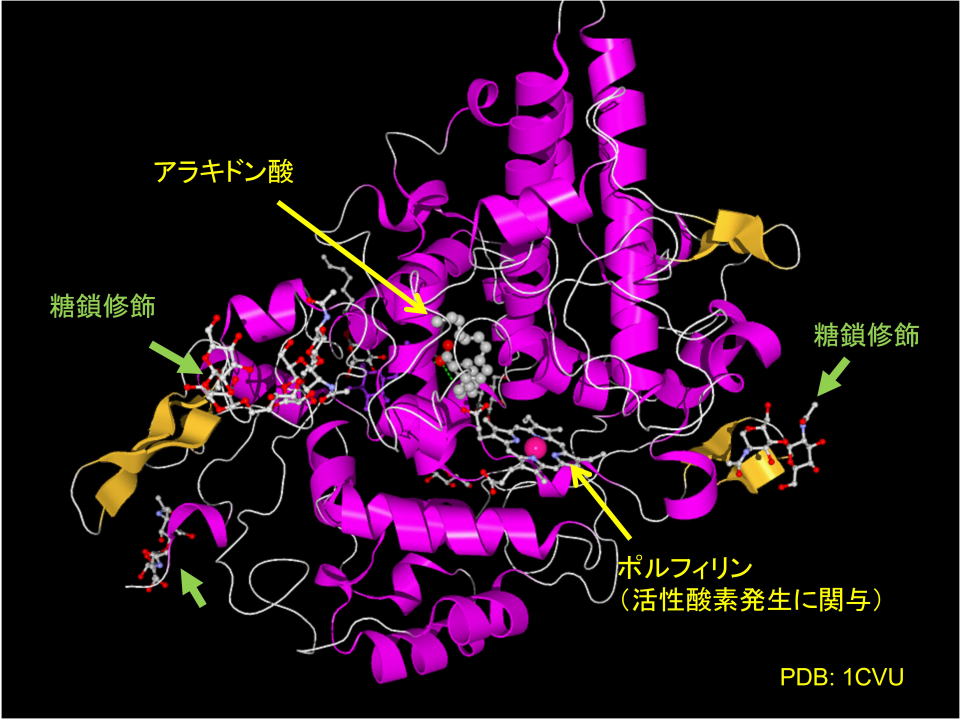
下にプロテインデータバンクに登録されているシクロオキシゲナーゼの構造を示します。
基質となるアラキドン酸が取り込まれて、ラジカル発生減のポルフィリンもすぐ近くに用意されていることが判ります。
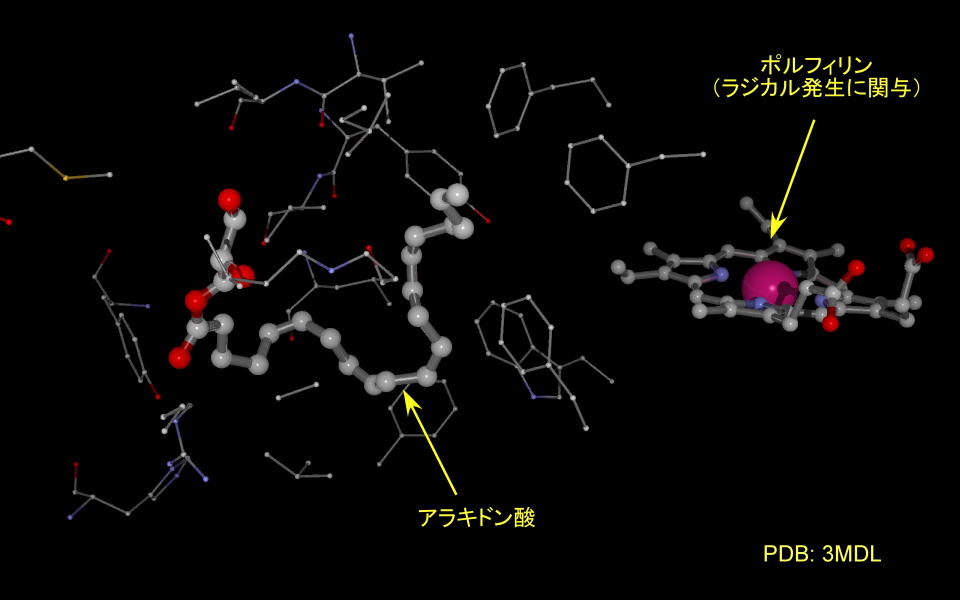
酵素の中央を除いてみると、アラキドン酸は疎水性のアミノ酸に取り囲まれており、環化反応が起きる炭素で曲げられていることが判ります。
基質にアラキドン酸そのものを使うと反応が進行してしまいますので、一部構造に細工がしてあります。
(ポルフィリンの中心金属もコバルトに置換されています。))
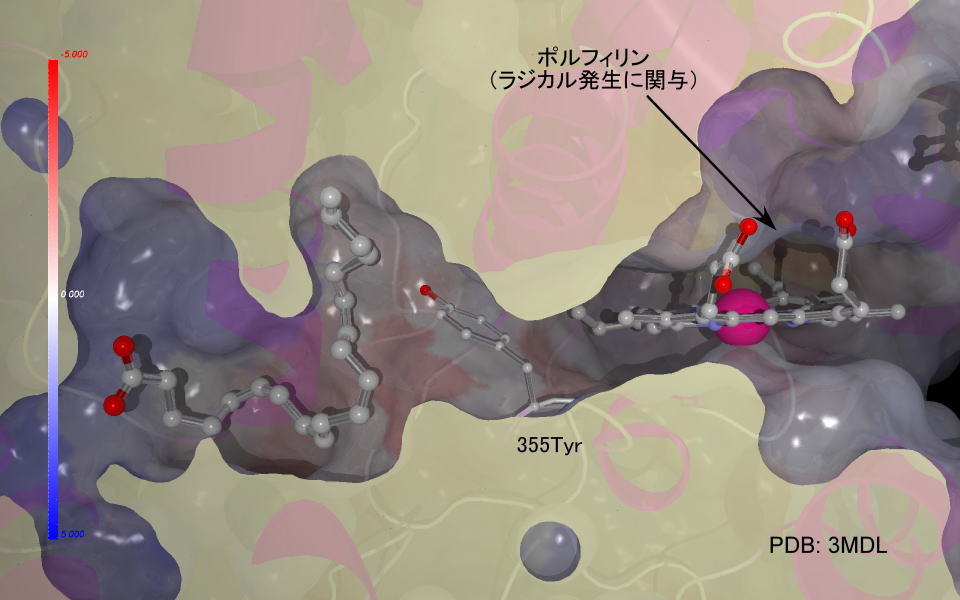
スライスを作ってみました。タンパク内部の表面にアラキドン酸が取り込まれ、折れ曲がった配座が強制されていることが判ります。
想像ですが、ポルフィリン環上で発生したスーパーオキシドアニオンラジカルを355番目のチロシンが曲げられたアラキドン酸に運ぶのではと思います。
3D図を示しました。(MolFeatプラグインが必要です)
(回転:左ボタンを押してドラッグ、拡大縮小:右ボタンを押してドラッグ)
このシクロオキシゲナーゼを阻害するのがアスピリンです。
アスピリン(アセチルサリチル酸)の原型は柳の樹皮から得られるサリシンです。
柳の樹皮の鎮痛作用は古くから知られており、紀元前90年ローマ時代に書かれた「薬物誌」にも登場するそうです。
また中国では葉が痛いときに柳の小枝をかじったそうですが、楊枝の語源になっています。
ただしとても苦く、簡単に口に入れられるシロモノではなかったそうです
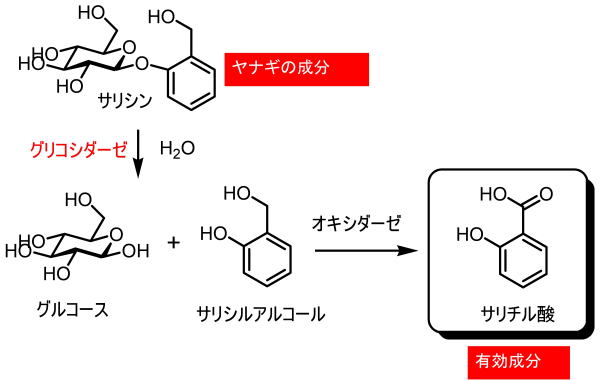
サリシンは配糖体で、体内ではサリシルアルコール(2-ヒドロキシメチルフェノール)とグルコースに加水分解します。
さらに酸化されたサリチル酸が鎮痛作用の正体だと思われました。
樹皮からの供給では量も、製造コストも実用的ではありませんでした。
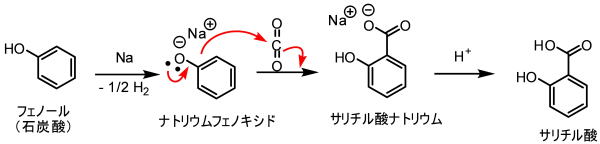
後に、コルベによってフェノールから安く合成ができるようになりました。
フェノールは石炭酸とも呼ばれ、石炭から大量に安価に得ることができます。
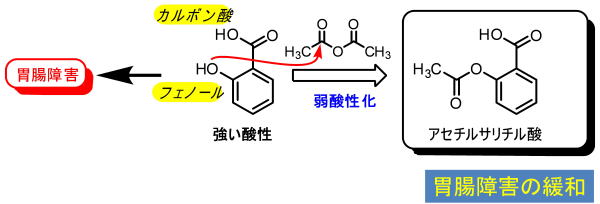
コストは下がりましたが、深刻な副作用(胃の障害)が問題になりました。
1897年にバイエル社はサリチル酸をアセチル化したアセチルサリチル酸(アスピリン)は副作用が低く、優れた鎮痛剤として完成させました。
アスピリンは現在世界で年間一億錠を超えて使用されているそうです。
国内ではバファリンが有名です。
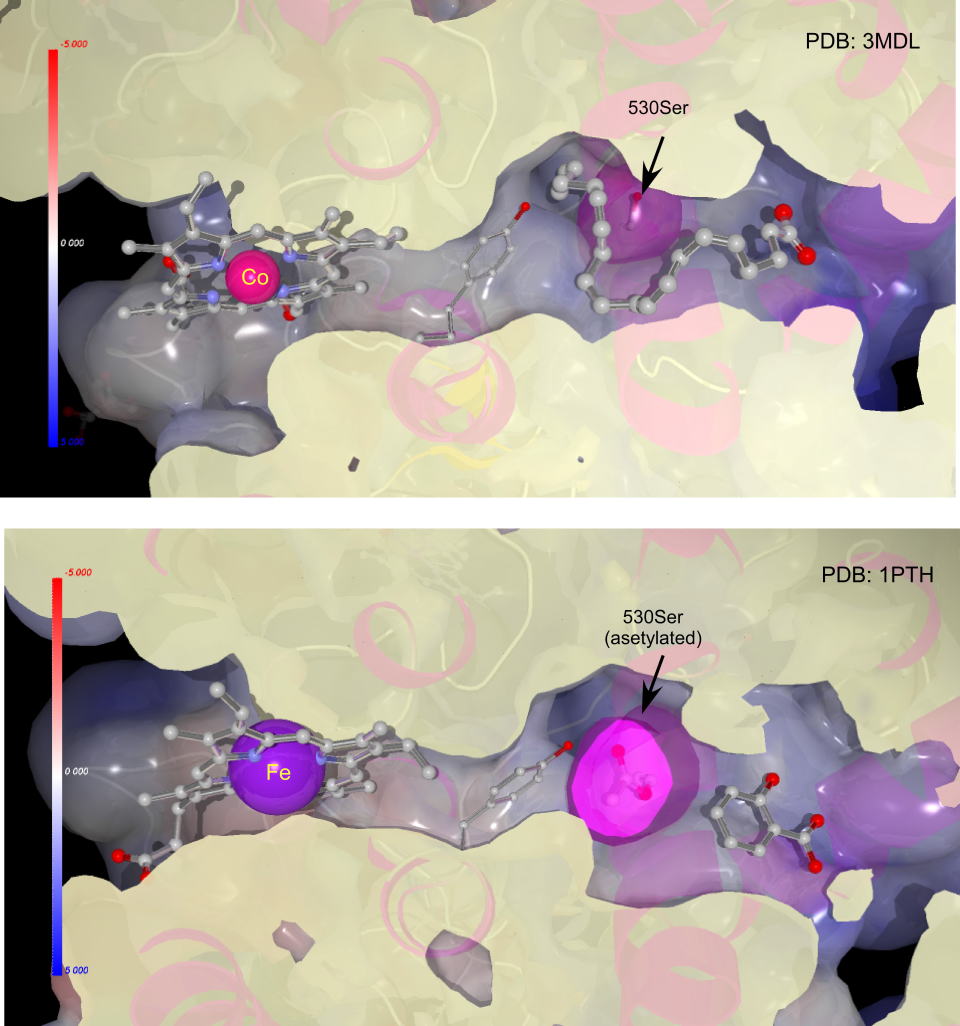
下の図は先ほどの裏側から見た図です。アセチル化されたタンパク質(1PTH)のポルフィリンでは本来の鉄ポルフィリンが挿入されています。
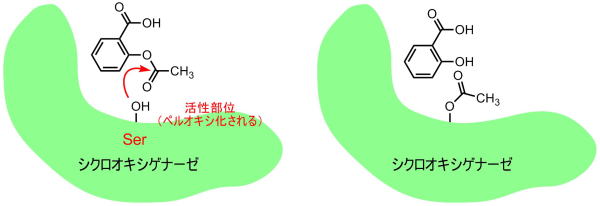
アスピリンは基質のアラキドン酸のカルボン酸部分を占有してしまいます。
さらに530番目のセリンはポルフィリン部で発生したスーパーオキシドアニオンラジカルを捕まえ、この位置からラジカル反応が開始します。また基質のアラキドン酸を折り曲げるのにも利用されていそうです。、アセチルサリチル酸のアセチル基とエステル交換によりアセチル化されると、ラジカルを捕まえることができず、反応が起きません。またセリン部分の容積が大きくなり、もはやアラキドン酸の入る余地は全くありません。
このためプロスタグランジンが、生成されず、頭痛が軽減できるのです。
プロテインデータバンクには複合体が複数登録されています。1PTHはブロモアセチルサリチル酸を使っています(実際には臭素原子はアセチル基に結合していますが表示していません。)
イブプロフェンも同様にシクロオキシゲナーゼに結合し、プロスタグランジンの生成を抑えて鎮痛作用を発揮します。
国内では「EVE」の商品名で売られていますが、本当のスペルは「IBUPROFEN」です。
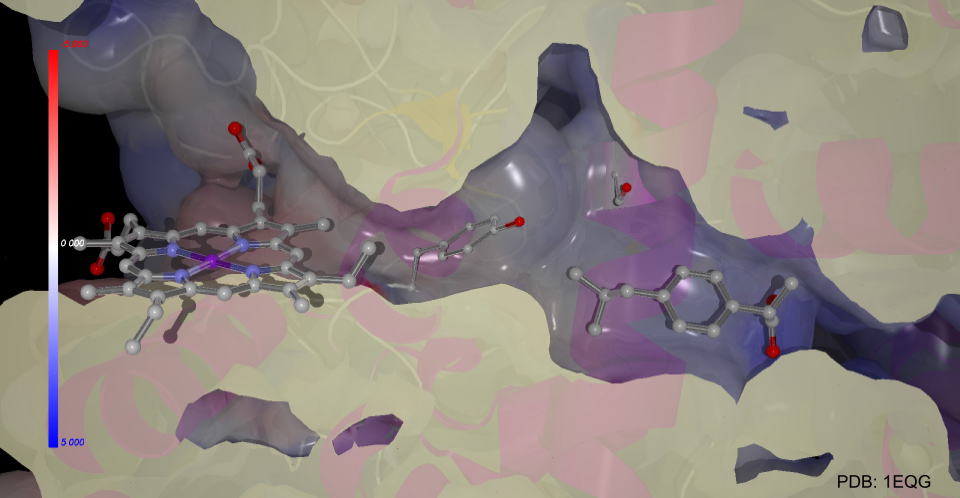
3D図を示しました。(MolFeatプラグインが必要です)
アラキドン酸のシクロオキシゲナーゼにはいくつか種類があり、その中でもシクロオキシゲナーゼ1 (COX-1)とシクロオキシゲナーゼ2(COX-2)とがあります。(最近脳内ではCOX-3というものが見つかっているそうです。)
アスピリンはCOX-1とCOX-2両者に結合してプロスタグランジンの生合成を阻害します。
しかし、COX-1は胃の保護に関与しているため、これが阻害されると深刻な胃腸障害を引き起こします。
従って、同じシクロオキシゲナーゼでもCOX-1を阻害せず阻害せず、COX-2に選択的に結合する薬剤の開発が望まれていました。
COX-2選択的阻害剤の開発が行われセレコキシブが開発されました。
国内では2007年に認可されました。
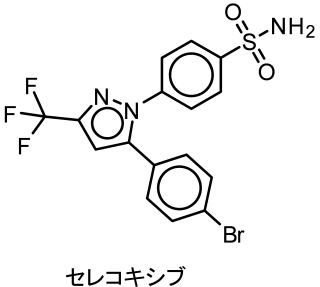
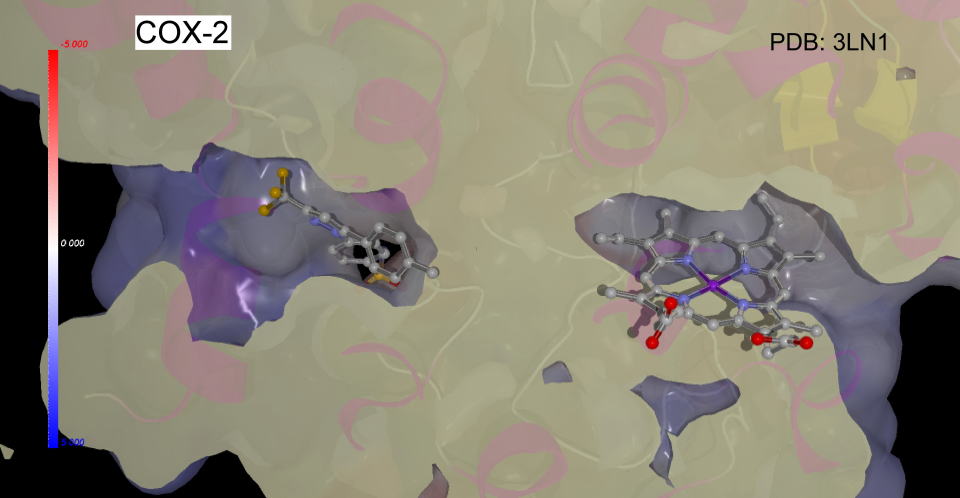
セレコキシブもシクロオキシゲナーゼ2のアラキドン酸が結合する場所に侵入していることが判ります。
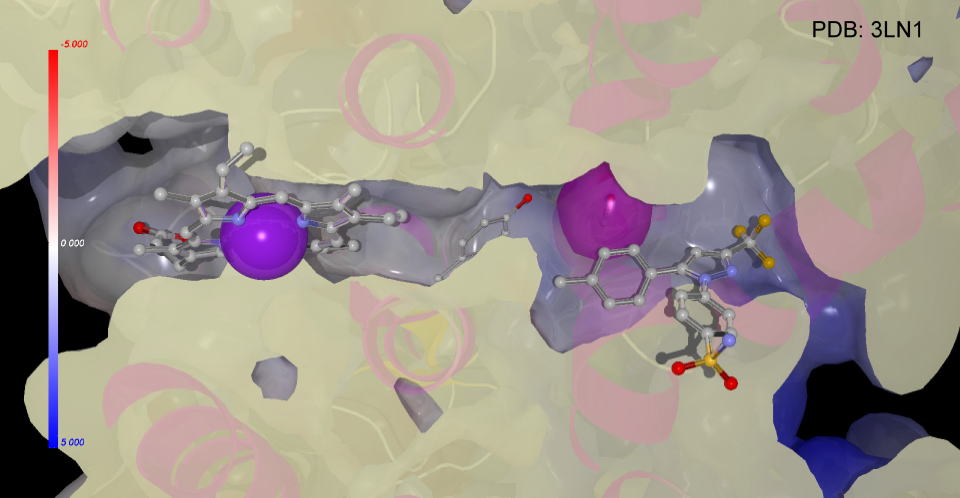
COX-2とセレコキシブ或いはアスピリンとの複合体を比較すると、たとえば上の図ではセレコキシブでは手前にスルホンアミド基が飛び出していることが大きな違いといえます。
裏側から見てみると下の図のようになります。
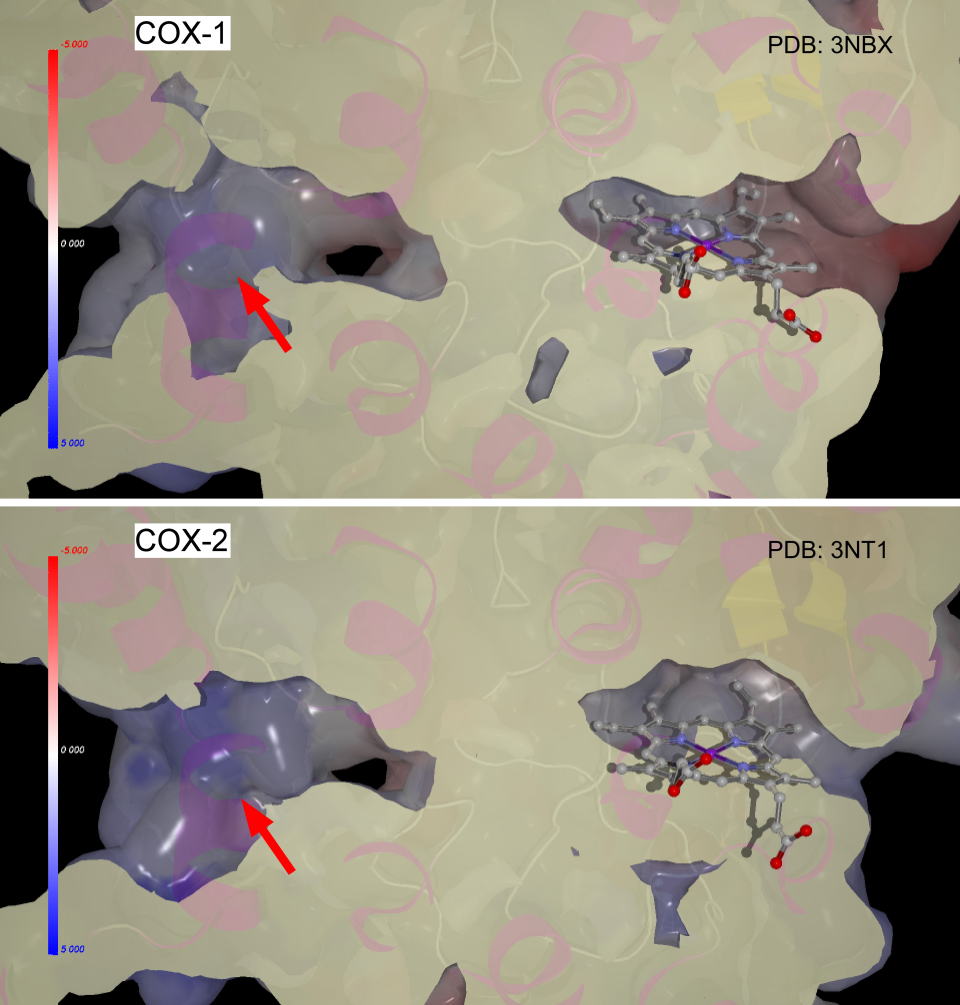
この位置がどうなっているのか比較してみました。アラキドン酸の入る空間にほとんど違いは見つかりませんが、
また、タンパク質の構造は基質の結合などにより少しずつ変化しますから、簡単に結合することはできませんが、ピラゾール環のトリフルオロメチル基もCOX-1,
COX-2の区別に重要な気がします。目で見ても区別が判りにくい結合部位空間の環境の違いをピコメートルレベルで最適化する現在の科学の力量を実感します。
頭痛薬のもう一つの代表選手はアセトアミノフェンです。ノーシンの主成分です。
アセトアミノフェンもシクロオキシゲナーゼに結合しますが、鎮痛作用を説明できるものではないそうです。
現在のところ真の機構は不明だそうです。
鎮痛作用の機構が異なるためか、アスピリンやイブプロフェンで副作用「アスピリン喘息」の現れる患者さんにも使用できるそうです。
頭痛薬ではありませんが鎮痛薬としてインドメタシンが知られています。
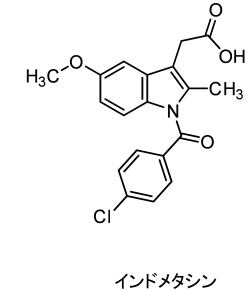
インドメタシンもシクロオキシゲナーゼに作用します。
経口の鎮痛剤としても使われますが、多の薬剤に比べ脂溶性が高いことから湿布や軟膏使った経皮吸収による投与が行われます。
インドメタシンの入っている湿布では、「痛みをとる」効果があります。
ただし、対処療法ですので、痛みを取り除いているだけです。
経皮吸収の場合、血中濃度が上がりづらい為副作用のリスクが下がるそうです。

、















