インフルエンザはインフルエンザウィルスによって引き起こされます。
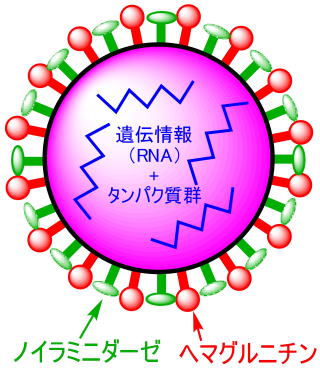
インフルエンザウィルスの詳細な構造は省略しますが、膜内には遺伝情報(RNA)とそれを維持するタンパク群、幕外にはヘマグルニチンとノイラミニダーゼという突起で構成されています。
インフルエンザウィルスはヘマグルニチンと呼ばれるタンパク質の先端で、宿主細胞を認識・結合しウィルスの遺伝情報を挿入することで感染します。
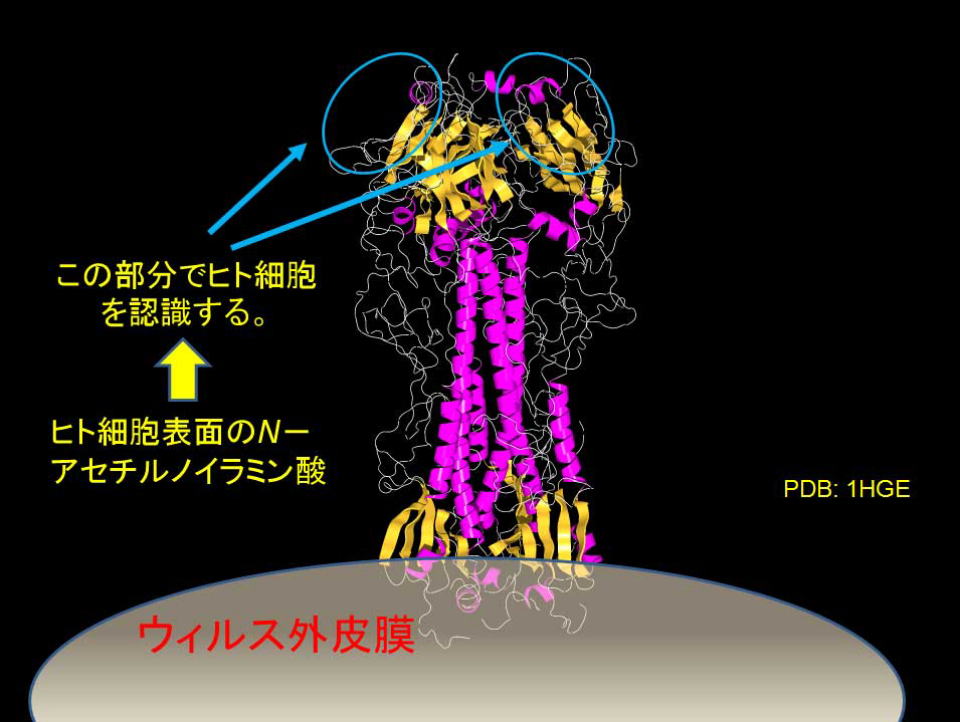
真上から見ると三量体構造であることが判ります。
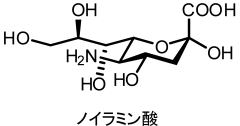
細胞認識には、宿主細胞表層のシアル酸と呼ばれるノイラミン酸を含む糖鎖を認利用します。
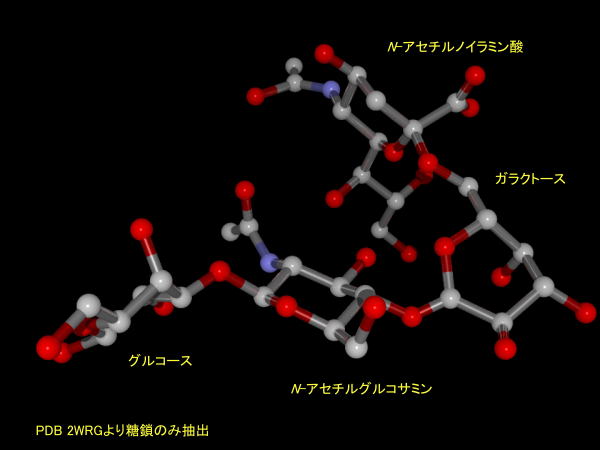
シアル酸にはらに複数の糖鎖が結合し、結合する糖や配列は種によって異なります。
ヒトのシアル酸はトリやブタのそれと似ているそうです。
もともとトリに感染していたウィルスのヘマグルニチンの構造が少し変化してヒトの細胞を認識できるようになったりするため、最近は野鳥が嫌われてしまう訳です。
H5型N2型インフルエンザとか言われますが、これは、ヘマグルニチン(H)、ノイラミダーゼ(N)との形だそうです。
ヒトの抗体はこれらの部分を認識しますが、インフルエンザウィルスのこのHとNの形が変わってしまうため、毎年予防接種が必要になるそうです。
最近までインフルエンザを根本から治療する方法は無く、対症療法のみでした。
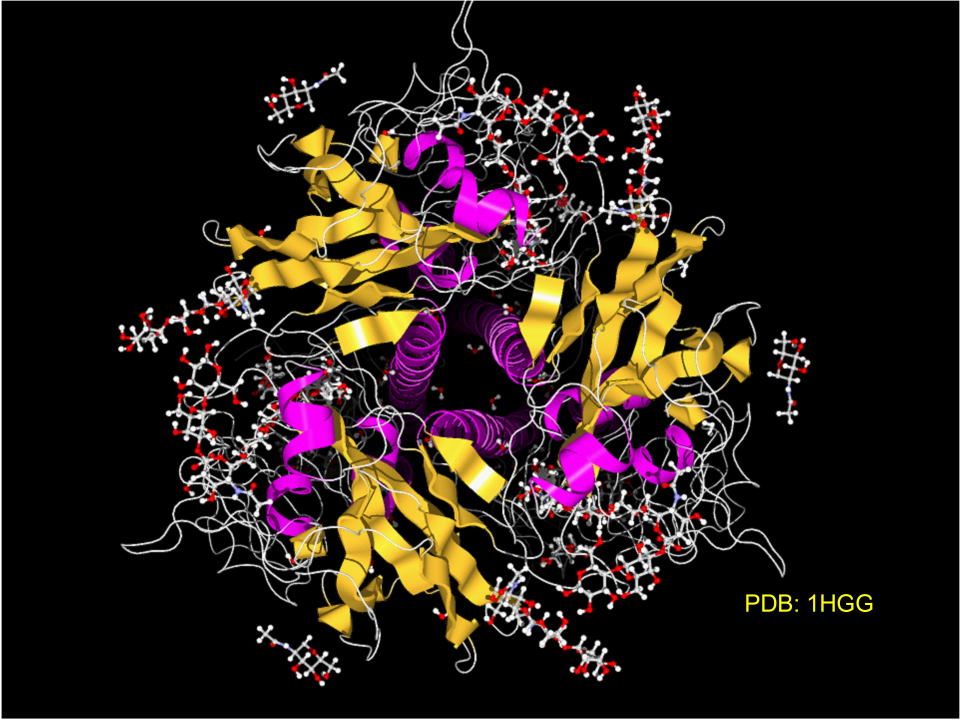
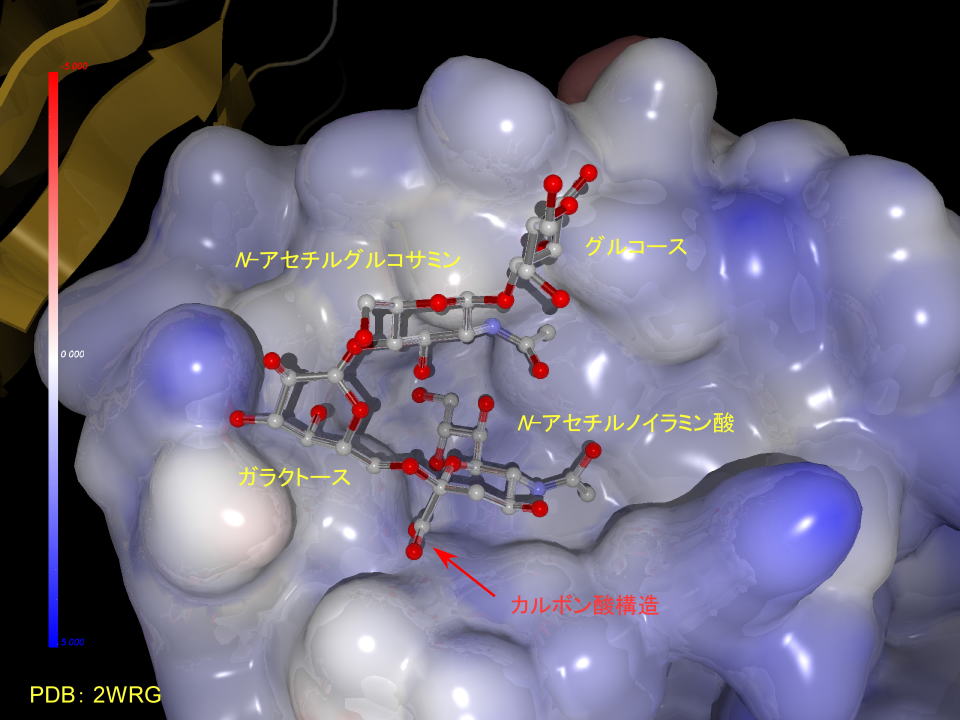
下にはプロテインデータバンク2WRGの認識するシアル酸を示しました。
3D図を示しました。(MolFeatプラグインが必要です)
(回転:左ボタンを押してドラッグ、拡大縮小:右ボタンを押してドラッグ)
ヘマグルニチンは、シアル酸構造を認識して細胞に結合します。
結合にはシアル酸のカルボン酸部の電荷を利用しているといわれています。
3D図を示しました。(MolFeatプラグインが必要です)
縮小していくとヘマグルニチンの全体構造が確認できます。
右クリックでシーン選択からsceen 1とすると認識部位のタンパク表面を削除した図になり、ノイラミン酸とタンパクとの水素結合を確認できます。
(回転:左ボタンを押してドラッグ、拡大縮小:右ボタンを押してドラッグ)
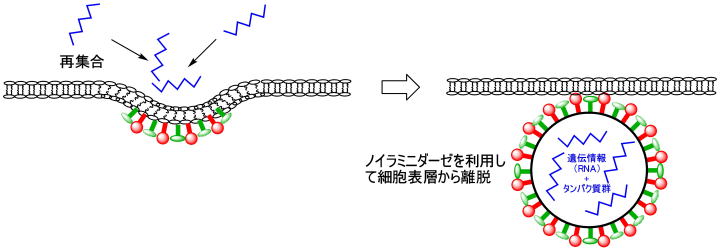
ウィルスの遺伝子情報は宿主細胞膜近くに再集合し、はやがて細胞から離脱します。
このとき最後に切り離すのが、ノイラミニダーゼです。この酵素が細胞表面の糖鎖を加水分解し離脱するわけです。
感染・離脱の様子は宇宙船がステーションにドッキングして、また離脱していくように感じますが、ウィルスごときが巧妙な手口を見つけたものだと感心してしまいます。
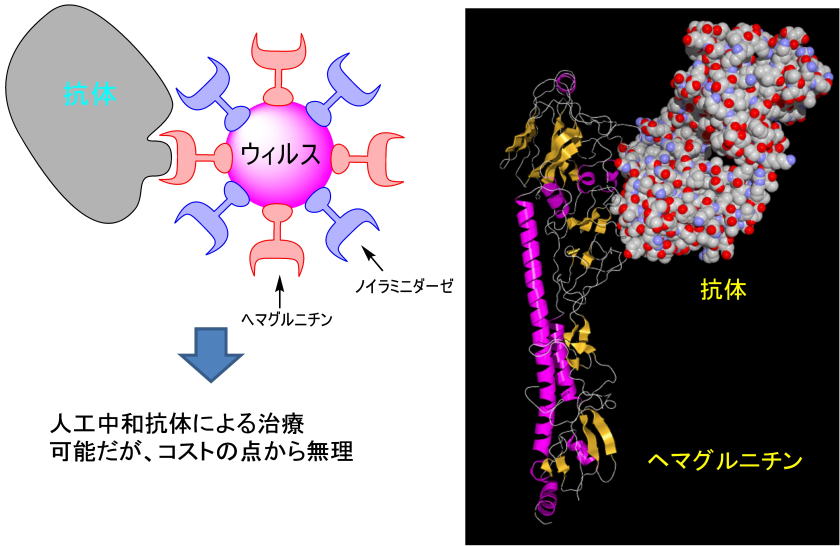
ヘマグルニチンや、ノイラミニダーゼを認識する抗耐薬品を開発すれば、理論的にはインフルエンザも治療可能です。
しかし、抗耐薬品はガンの治療ならともかく、インフルエンザ治療に利用できるような製造コストではなく、現実的ではありません。
ワクチンとして、ヘマグルニチンやノイラミニダーゼのかけらを体内に注射して、抗体を形成、感染を防ぐといった方法がこれまでの方法でした。(現在でも最も有効な方法です。)
シアル酸類似構造をヘマグルニチン阻害剤とすれば、これもインフルエンザ治療に使えるはずですが、このような薬剤はまだ開発できていないそうです。
従って、ノイラミニダーゼを阻害することができれば、インフルエンザウィルスは離脱することができず感染は停止してしまうはずです。
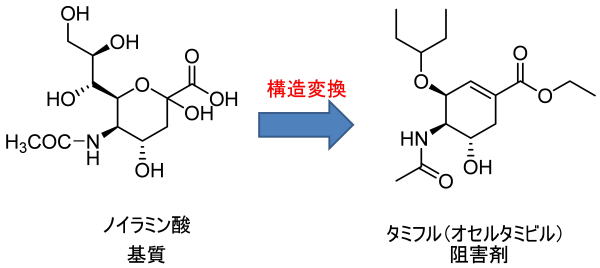
このような考え方で開発されたのがリレンザ・タミフルです。
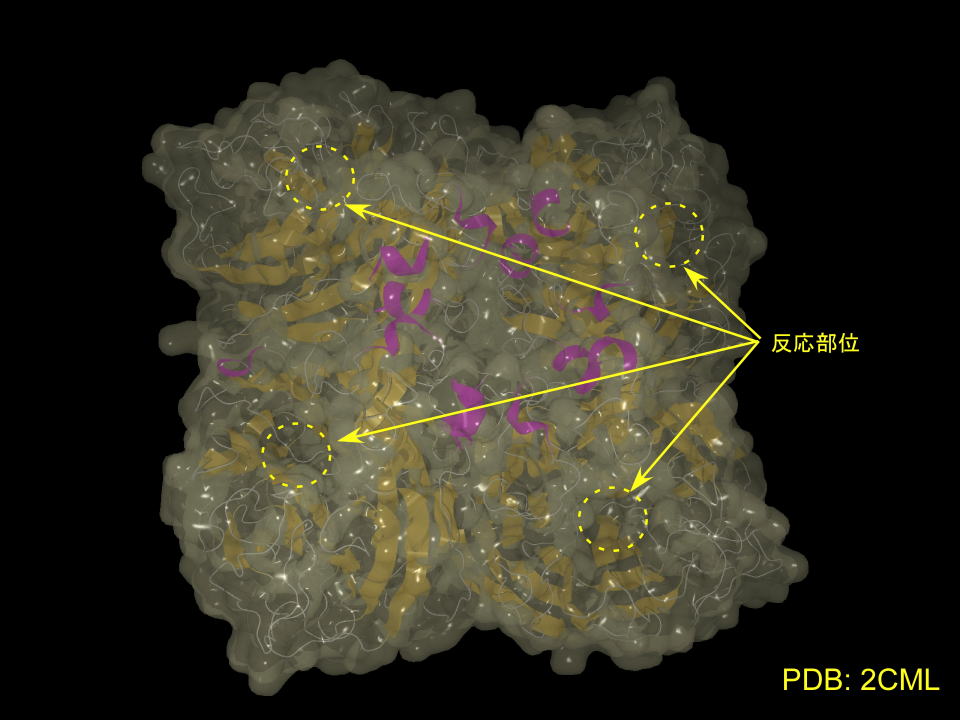
まず、ノイラミニダーゼの構造を見てみます。
ヘマグルニチンが3量体構造であったのに対し、ノイラミニダーゼは4量体構造を取っています。
中央部にくぼみがあり、ここでシアル酸を加水分解します。
3D図を示しました。(MolFeatプラグインが必要です)
右クリックでシーン選択からsceen 1とするとCPKモデルになり、反応部位のくぼみを観察しやすいと思います。。
(回転:左ボタンを押してドラッグ、拡大縮小:右ボタンを押してドラッグ)
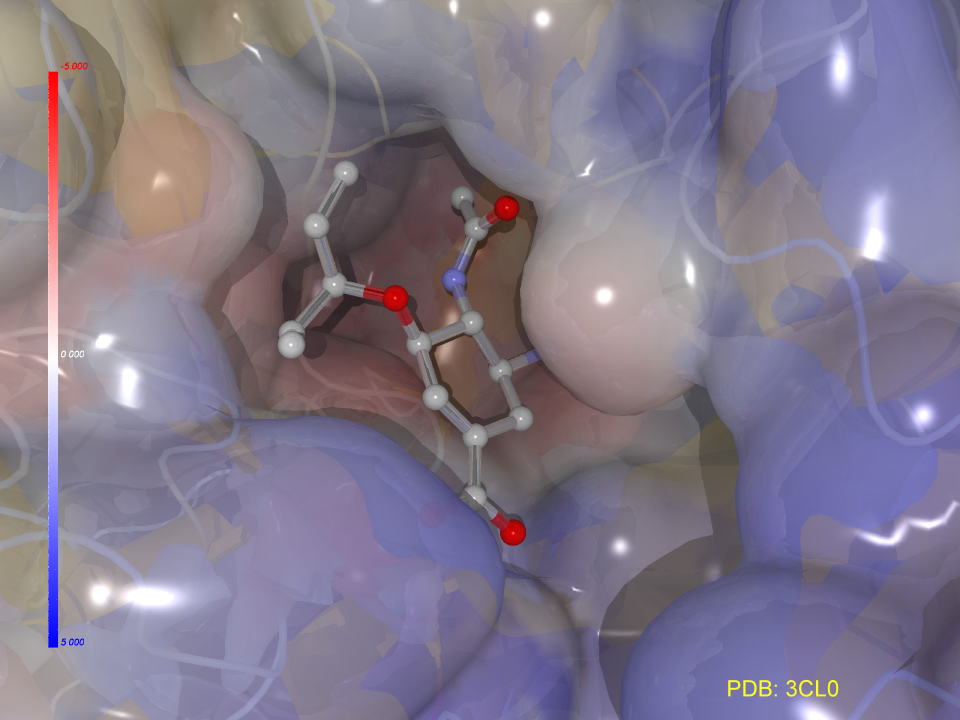
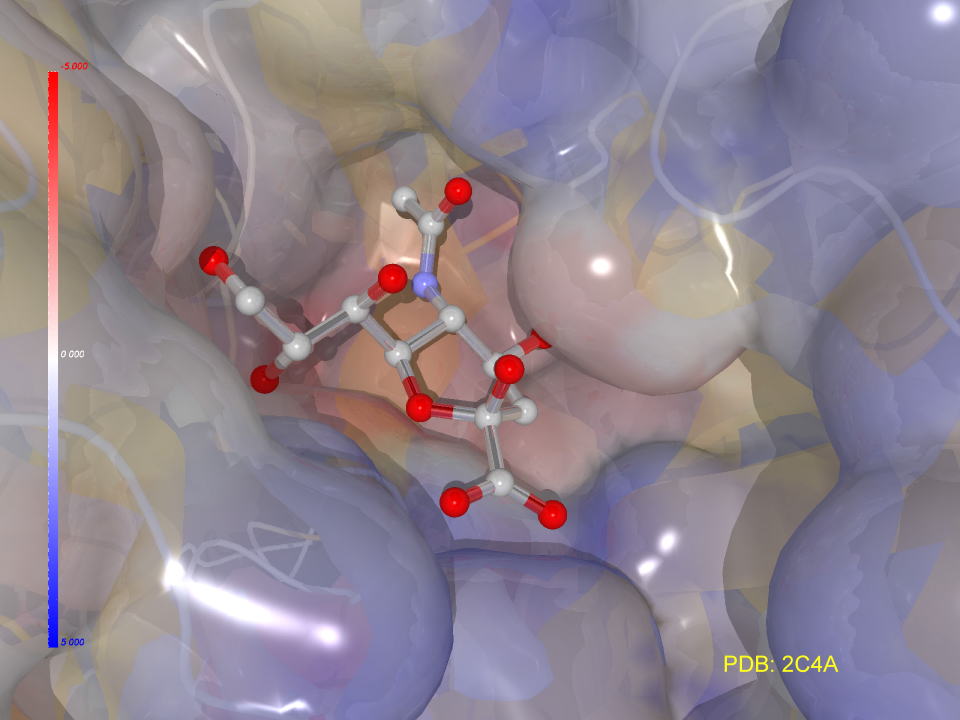
下の図はノイラミニダーゼの結晶ににシアル酸を加えて30分間放置した(そーキング実験といいます。)X線結晶解析の図です。
反応部位に加水分解されたシアル酸が入っていることが判ります。
この部位に天然基質よりより強力に結合する物質があれば、本来の基質が入ることができず、ノイラミニダーゼは阻害されることになります。
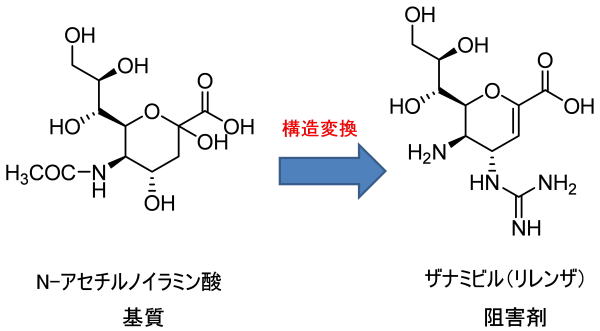
リレンザ(ザナミビル)このような考え方で開発されました。
糖で言う4位水酸基の結合力を高めるためにグアニジン基を導入しています。
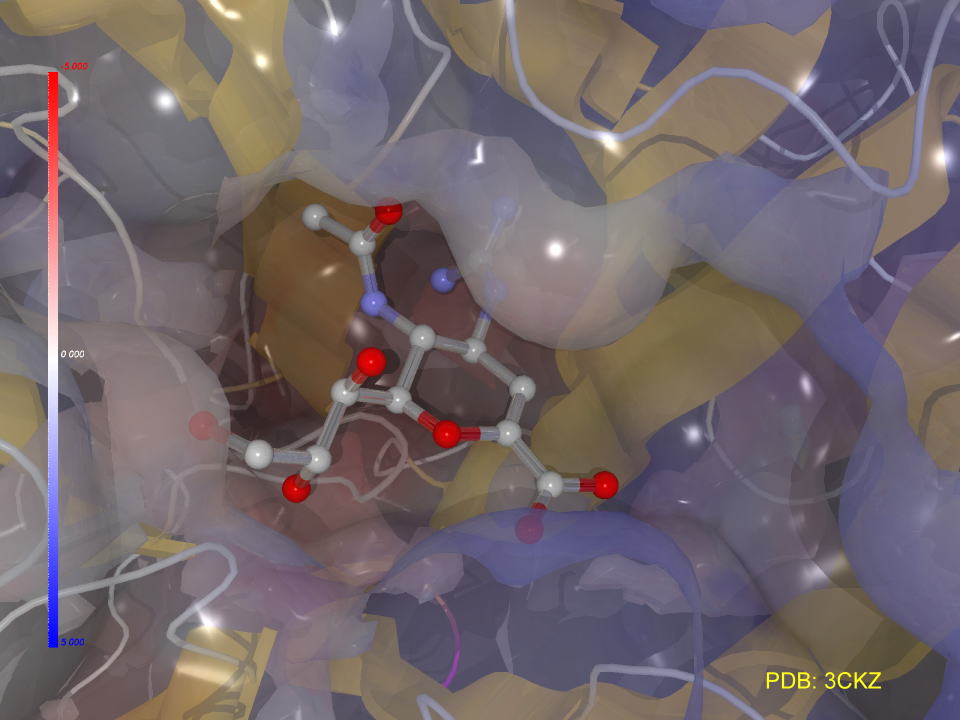
下の図は、プロテインデータバンク3CKZに登録されているノイラミニダーゼとリレンザとの複合体です。
グアニジン基がしっかりと根を生やしていることが判ります。