ペニシリン

ペニシリンは1928年イギリスの生化学者、アレクサンダーフレミングによって、青カビ汁から見出されました。
フレミングのセレンディピティックなペニシリンの発見はとても有名です。
しかし、フレミングの化学の知識では単離することもできず、「抗菌物質の存在」と青カビの学名(Penicilium)からペニシリンと名付けたことに留まっていました。
1940年に、ハワード・フローリーとエルンスト・ポリス・チェーンが単離(実際にはペニシリンG、ペニシリンGの混合物)に成功、凍結乾燥技術によりある程度の量の製造にも成功していました。
そして、フローリーの部下であるノーマン・ヒートリーという化学者がその実用性を証明しました。
1940年5月、空襲管制のため真っ暗なオクスフォードの町の実験室、ヒートリーは連鎖球菌を注入したマウスで実験をしました。
ペニシリン注射しなかった4匹のネズミは朝までに全て死んでしまったのに対して、ペニシリン注射をしたマウスはすべて大丈夫だったそうです。
これにより、ペニシリンの実用性が証明されましたが、臨床に応用するにはペニシリンが足りませんでした。まだ大量生産ができませんでした。
戦時中でイギリスの工場の多くは破壊され、稼働中の工場は軍事物資の生産で目一杯だったそうです。
カビの培養は通常ガラス容器で行うのですが、ヒートリーは陶器製容器で培養する方法を考案し、100マイルも離れた工場に頼んで作ってもらい、174個の陶器製培養容器を受け取りました。
その容器で培養を開始できたのは1940年のクリスマスイブだったっそうです。
これにより、ペニシリンの量は臨床実験に用いることができるレベルに達しました。
彼らは、さらにバラの刺でけががきっかけで、ブドウ球菌と連鎖球菌の感染で瀕死の警察官に処方しました。サルファ剤では効き目が全くなかったそうです。
ペニシリン投与後、その警察官は直ちに快方に向かったそうです。しかし、その警官はペニシリン投与終了後10日ほどで再び感染症が悪化し、死亡してしまいました。
まだペニシリンの供給が十分でなかったのが原因だそうです。
この警察官の尿から回収したペニシリンを使って、術後感染症で瀕死の別の少年にも処方したところ、何と平熱に戻ったそうです。
フローリーとヒートリーはさらに数例の臨床例をあわせて、論文(ランセット誌)として発表しました。
戦時中のイギリスでは工業化は難しく、手を差し伸べたのはアメリカのロックフェラー財団とアンドリュー・J・モイヤーでした。
彼らはアメリカで培養法を改良して、実用化に十分な生産方法を確立しました。
奇しくも第二次世界大戦の真っただ中、ペニシリンの登場は計り知れない多くの兵士の命を救ったはずです。
ペニシリンの功績をたたえて1945年にノーベル生理医学賞が与えられていますが、受賞したのはフレミング、フローリー、チェインで、大部分を手掛けたヒートリーは受賞していません。
ノーベル賞には各部門3人までという制限があるためです。
最後にペニシリンプロジェクトに参加したモイヤーが、研究開始時の約束を破ってヒートリーを共著者から外してしまった事もその一因かもしれません。
イギリス人であるフレミングが発見して、イギリスオクスフォードのフローリー、ヒートリーが開発したペニシリンですが、最終段階がアメリカであったために、ペニシリンの特許料はイギリスにはほとんど入っておらず、それどころか、イギリス人でさえアメリカに支払っているのも皮肉です。
ちなみに、テレビドラマ「Jin-仁」では主人公の南方仁が青カビからペニシリンを製造していましたが、芝哲夫先生の「化学物語25項」によれば、「谷中の笠森(瘡守)稲荷は徳川家康がカビの汁で、刀傷をいやしたことかはじまり」だそうです。
本当なら日本人はペニシリンよりも300年も前に抗生物質を利用していたことになります。
<参考> Emsley "Molecules at an Exiition"
ペニシリンはバクテリアの細胞壁合成を阻害します。
ヒト細胞には細胞壁は存在しないため、細胞壁阻害があっても全く影響しません。
バクテリアの細胞壁はN-アセチルグルコサミンとN-アセチルムラミン酸とが交互につながって形成されています。
N-アセチルムラミン酸の酸部分にはL-Ala-D-Glu-L-Lys-D-Ala-D-Alaの五個のアミノ酸が結合しています。
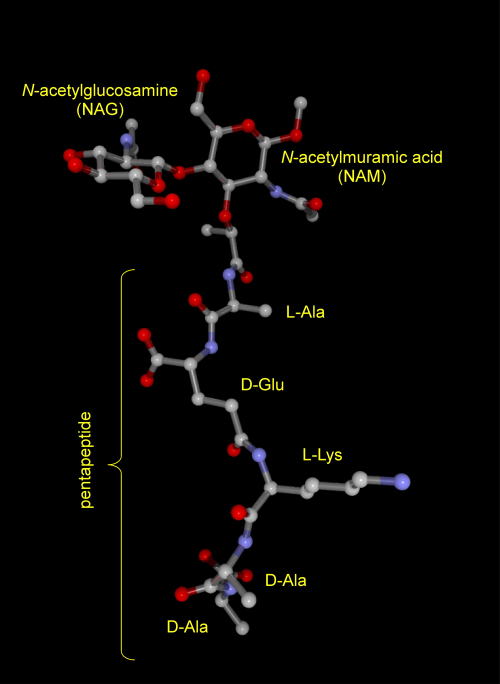
左ボタンを押してドラッグすると分子を動かすことができます。
(MolFeatプラグインが必要です。)
このLys側鎖のアミノ基にさらにペプチド鎖で伸びていて、末端のアミノ酸のアミノ基が別のペンタペプチドの末端のD-Alaと置換します。
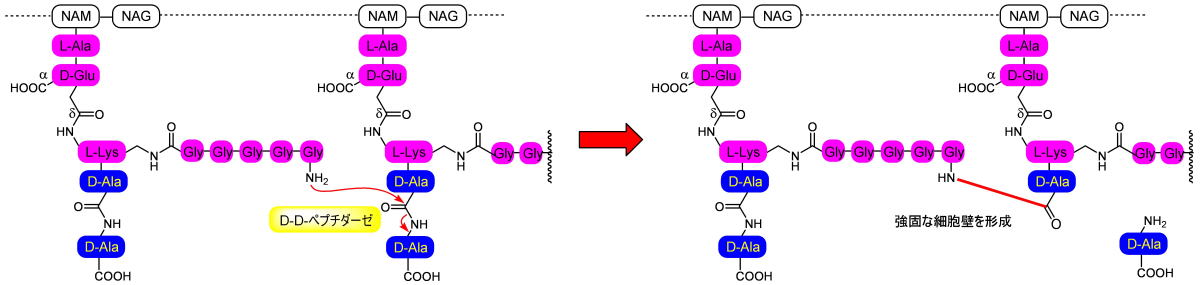
これにより、細胞壁は二重の共有結合によって強固なものになります。
この反応を触媒するのがDD-ぺプチダーゼです。
DD-ぺプチダーゼがD-Ala−D-Alaの構造を認識、取り込んだ後、反応部位のセリン残基の水酸基がC末端から二つ目のD-Alaカルボニルを攻撃して末端のD-Alaを追い出します。
そののち別のペンタペプチド側鎖のアミノ基がエステルアミド交換反応を起こして、一連の反応を完了させます。
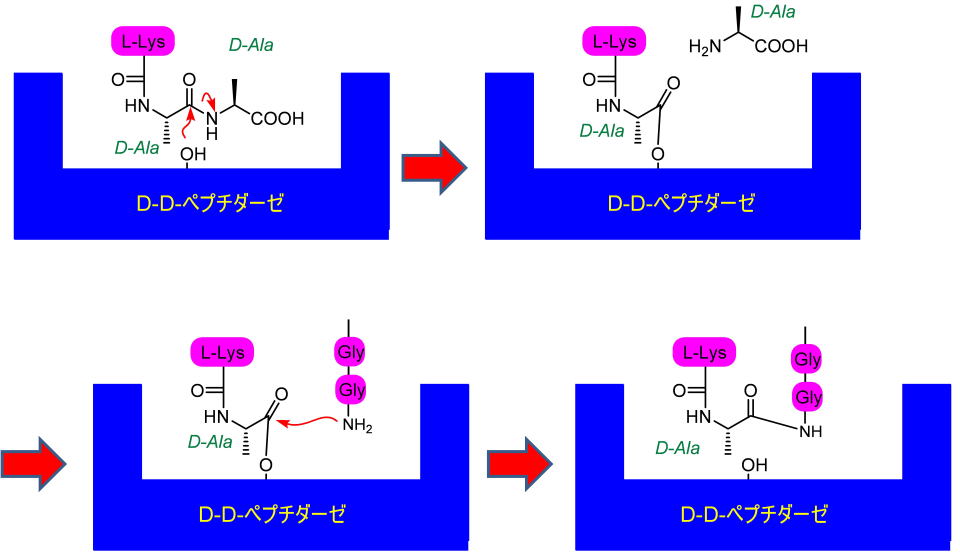
ペニシリンはこの酵素の働きを阻害します。
従って、阻害されたバクテリアの細胞壁は非常にもろいものとなり、内容物が外に染み出てしまう訳です。(溶菌)
左ボタンを押してドラッグすると分子を動かすことができます。
(MolFeatプラグインが必要です。)
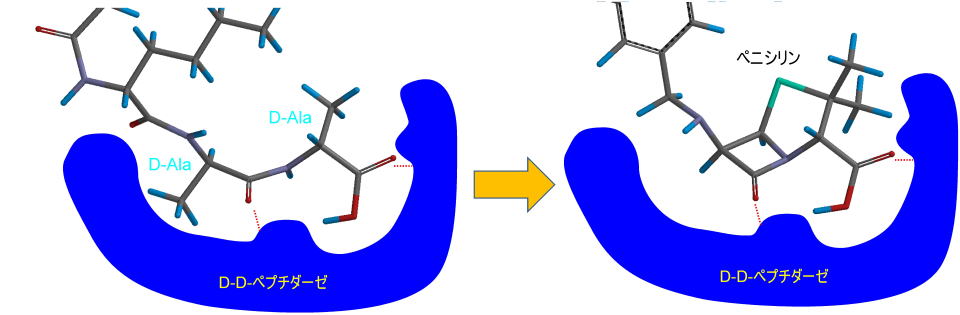
ペニシリンの構造はペンタペプチド末端のD-Ala-D-Alaという部分構造に類似していて、上記のDD−ぺプチダーゼは本来の基質であるD-Ala-D-Alaという部分構造とペニシリンを間違えて取り込んでしまいます。
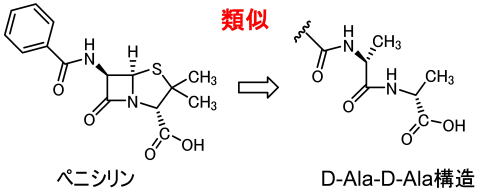
上の図では構造が似ているといわれても実感がわきません。
分子モデリングソフトで重ねてみると構造の類似性を実感することができます。
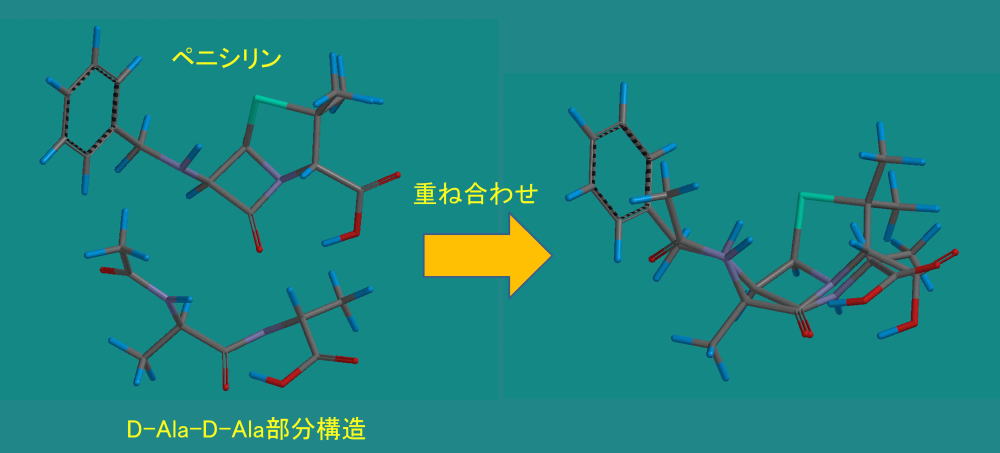
このように構造が似ているため、DD-ぺプチダーゼはペニシリンを間違えて取り込んでしまう訳です。
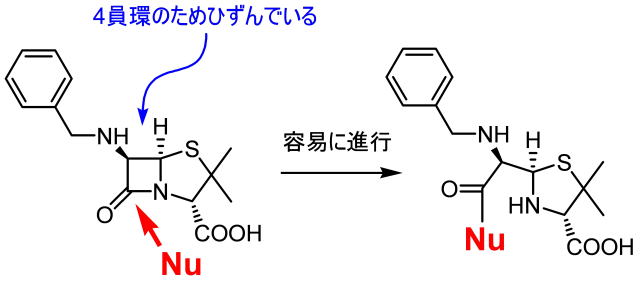
さらに、ペニシリンには巧妙な仕掛けが施されています。ペニシリンはβラクタム系抗生物質と呼ばれますが、このβラクタム構造(環状のペプチドで4員環を形成している)は4員環と結合角に大きな歪みを持っていて、DDぺプチダーゼ反応部位セリン残基水酸基と反応して共有結合でつながってしまいます。その結果、もうペニシリンはDD-ぺプチダーゼから離れることはできません。DD−ぺプチダーゼから見たら、余計なペニシリン構造が大事な反応部位セリンにくっついてしまったのでもう働くことはできません。
従って、ペプチドグリカンの生合成ができなくなってしまうのです。
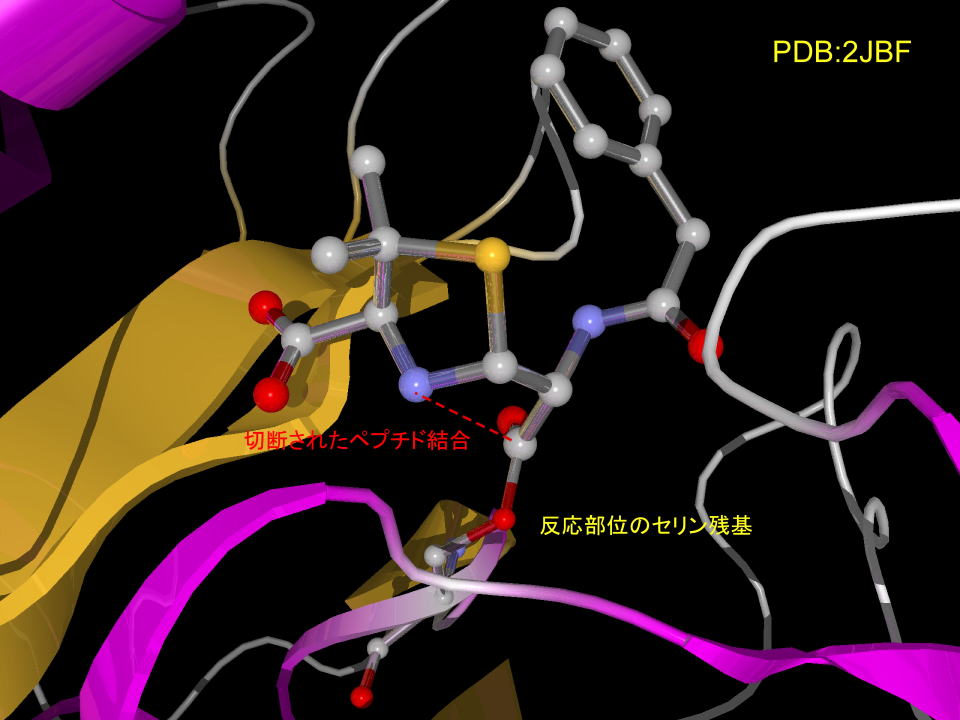
jX線結晶解析では下のように観察されます。
3D図を示しました。(MolFeatプラグインが必要です)
(回転:左ボタンを押してドラッグ、拡大縮小:右ボタンを押してドラッグ、左ボタン長押しで現れたメニューから自動回転を選択すると回転を続けます)
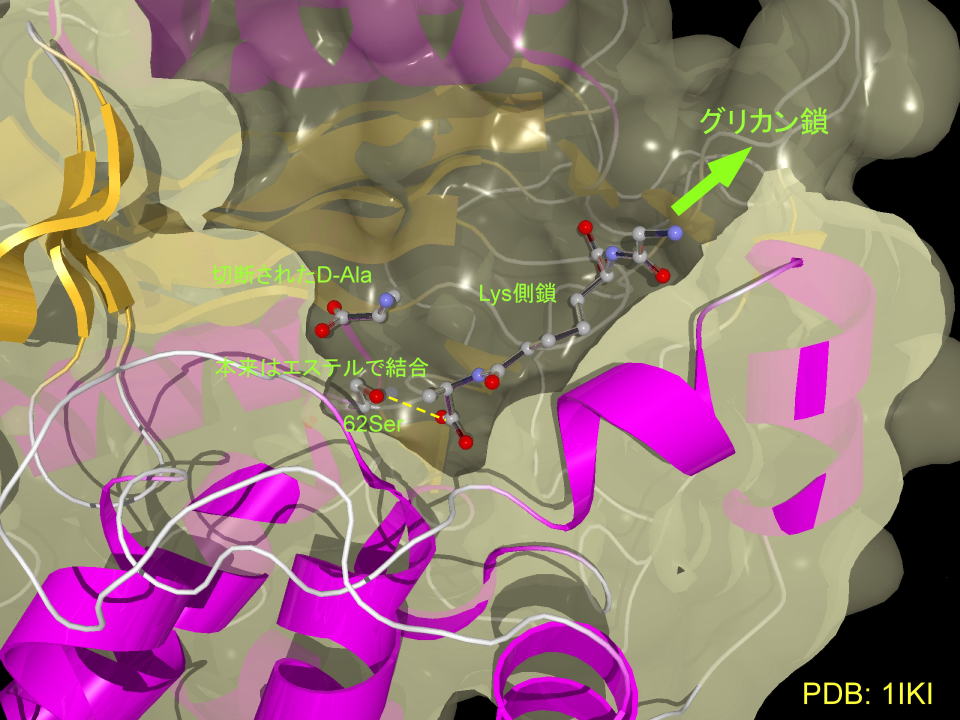
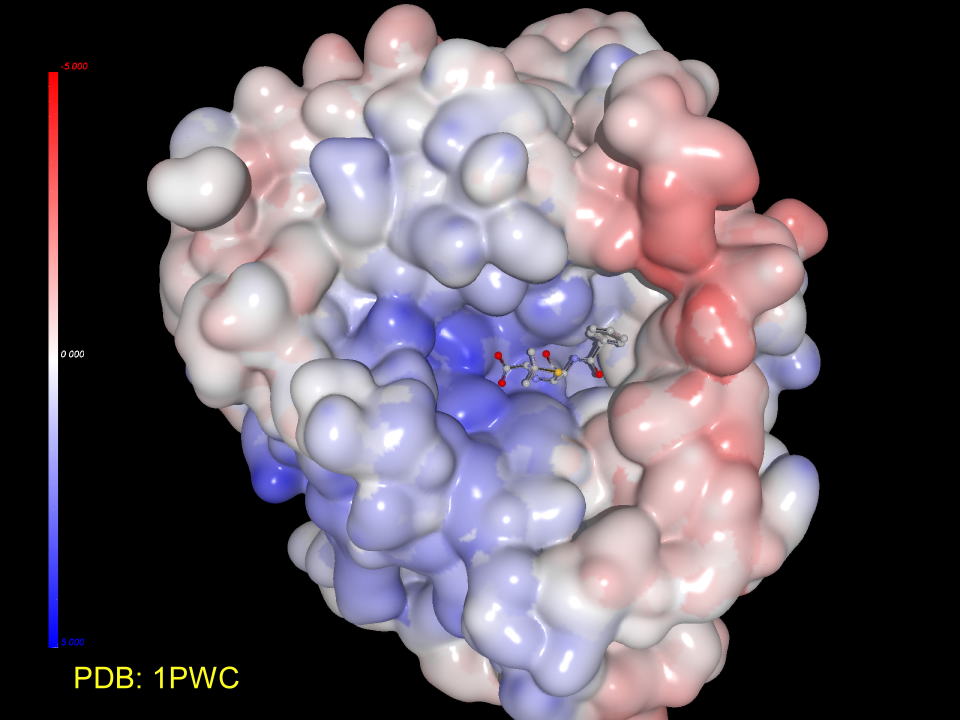
DD-ぺプチダーゼのタンパク表面を表現すると、ペニシリンはタンパクのポケットに挿入されていることが判ります。
3D図を示しました。(MolFeatプラグインが必要です)
くるくる回すとよくわかります。
(回転:左ボタンを押してドラッグ、拡大縮小:右ボタンを押してドラッグ、左ボタン長押しで現れたメニューから自動回転を選択すると回転を続けます)
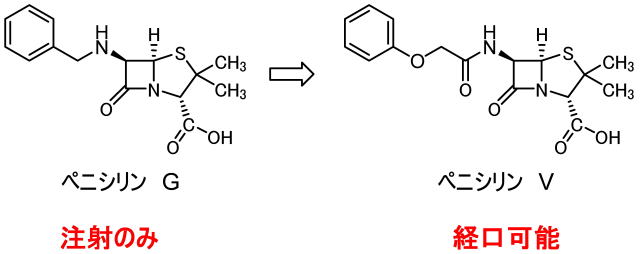
ペニシリン(ペニシリンG)の問題点はその安定性でした。
ペニシリン不安定さはβラクタム構造にあり、その不安定さを解消するために、DD-ぺプチダーゼの活性部位のセリンと反応、これが抗菌活性の理由でした。
この不安定さが原因で、ペニシリンは注射により体内に入れる必要がありました。経口投与では、胃液の中で全て分解してしまうからです。
人類は、様々な誘導体を試し、ペニシリンVを開発しました。
ペニシリンVは経口で摂取可能な抗生物質です。現在は多くの経口ペニシリンが開発されています。
耐性菌の出現
ペニシリンの発見は多くの人々を感染症から救いました。
しかし、ペニシリンの出現が新たな問題を引き起こしてしまいました。
それは耐性菌の出現です。
生物は皆、進化によって現在の形態に至っています。
進化の意味はいろいろと難しいのですが、生命は、進化という形で生体が変化し続けることで、地球環境の変化にも滅びることなく現在に至っています。
地球環境が変化しない場合は、いわゆる突然変異で、生体変化が種の存続に不利な形となって滅びてしまいます。
進化と突然変異は同義で、偶然都合の良い生態変化のときのみ進化とよび、それ以外は突然変異とする結果的なモノです。
カビのような菌も突然変異が起きます。その頻度は私たち人に比べた場合、それは高いものです。
突然変異の結果、偶然にもペニシリンが効かない菌に変わってしまった場合どうでしょうか?
在来の菌はペニシリンによって全滅してしまっているので、そこは栄養を独占できる宝庫です。
そのうち、増殖力も進化してしまえば、増え放題です。
ペニシリンを使っても効き目がありません。これが「耐性菌」です。
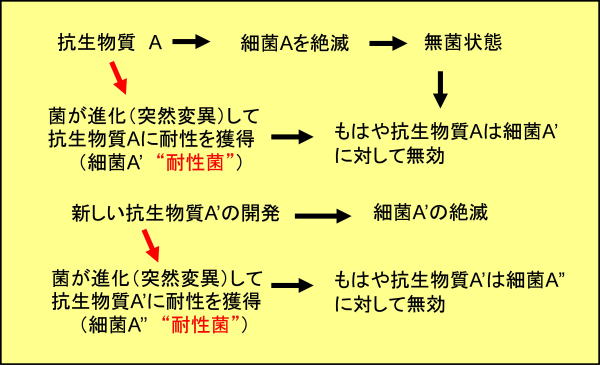
人は耐性菌にも有効な新しい薬剤を開発しますが、時間の問題でまた新しい「耐性菌」が出現するというイタチごっこです。
しまいにはどの抗菌剤にも効かない「多剤耐性菌」が出現してしまいます。
病院では、様々な患者に様々な抗生物質を使用します。壁やイスも抗菌剤で十分に消毒します。
このような環境で生育可能な菌はまさしく「多剤耐性菌」の可能性大です。
そのような菌が強い増殖力まで獲得していることは進化という確率的にも低いはずですが、免疫力が低くなっている病人や老人に侵入した場合、一気に増殖してしまう可能性がありますl。
これが「院内感染」、「日和見感染」と呼ばれるもので、どんな薬も効かないということになりかねません。
用もなく子供を大病院に連れていくことは、非常に危険でありますね。
ペニシリンが実用化されたのは1940年代ですが、すでに1960年代には耐性菌が問題になっていたそうです。
この耐性菌にはペニシリンGが効きません。
バクテリアのDD-ぺプチダーゼがペニシリンによって破壊されるため、そのバクテリアはダメージを受けるのですが、理論的にはペニシリンの数よりもたくさんDD−ぺプチダーゼを生産すれば、無傷のDD−ぺプチダーゼが存在することとなり、バクテリアは存命可能になります。
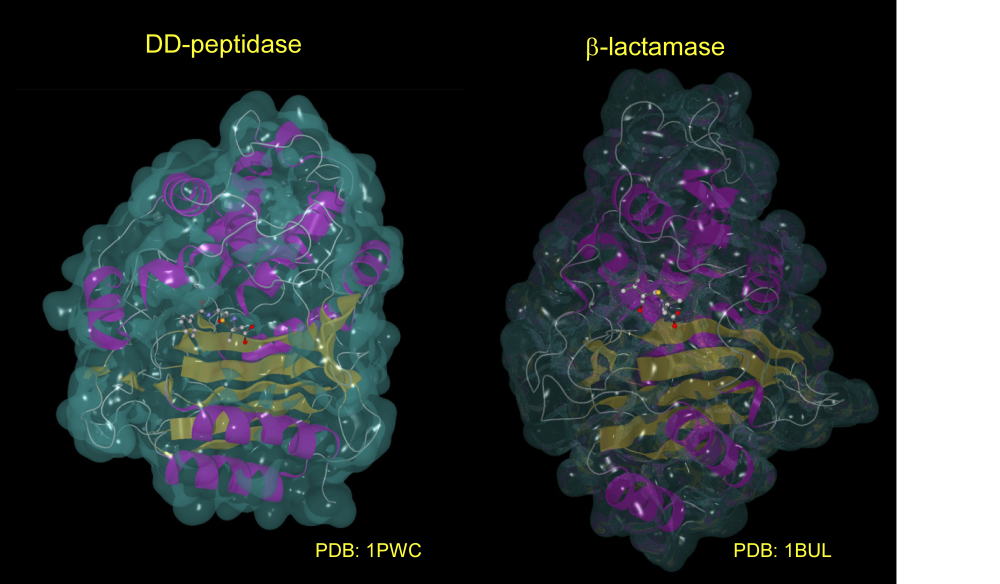
バクテリアの進化は、DD-ぺプチダーゼ以上にペニシリンに結合しやすいタンパク質、βラクタマーゼ(ペニシリナーゼ)を作ってしまいました。
バクテリアはβラクタマーゼをゼロから開発したわけではありません。DD−ぺプチダーゼの構造をほんの少し変化させることで、DD−ぺプチダーゼとは別のペニシリンにより結合しやすいβラクタマーゼに進化させた、ペニシリンはこのニセモノに全て捕まってしまう訳です。
DD−ぺプチダーゼとβラクタマーゼの構造を比較すれば、基本的にβデコイと呼ばれる自分のニセモノを後ろに発射して、ミサイルの進路をそちらに向けさせるそうですが、それに似ています。
下は二つのタンパク質の比較です。シート構造、ヘリックス構造の数や長さなど基本的に同じであることが判ります。
では、人類はどのようにして耐性菌に有効な抗生物質を得たのかを考えてみましょう。
言うまでもなく、耐性菌を対象としたスクリーニングから見つかった新規抗生物質も複数あります。
ここでは、半合成ペニシリンの一つメチシリンを例に考えていきます。
メチシリンはβラクタマーゼに対抗する最初の薬剤です。
バクテリアがペニシリンに対抗すべく、生産するβラクタマーゼは、ペニシリンが標的とするDD-ぺプチダーゼより先に結合する必要があります。
言い換えれば、より完璧にフィットする必要があります。
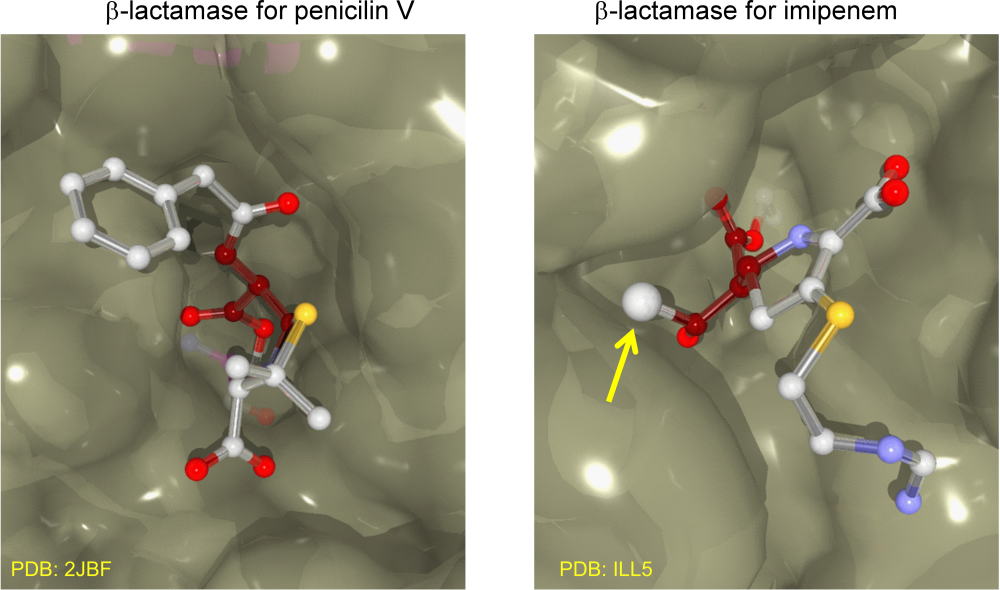
下には、ペニシリンV(ベンジルペニシリン)とその耐性菌によるβラクタマーゼとの複合体を示しています。
まさに隙間なく、ペニシリンVが結合しています。言うまでもなく、βラクタム環はβラクタマーゼによって破壊されています。
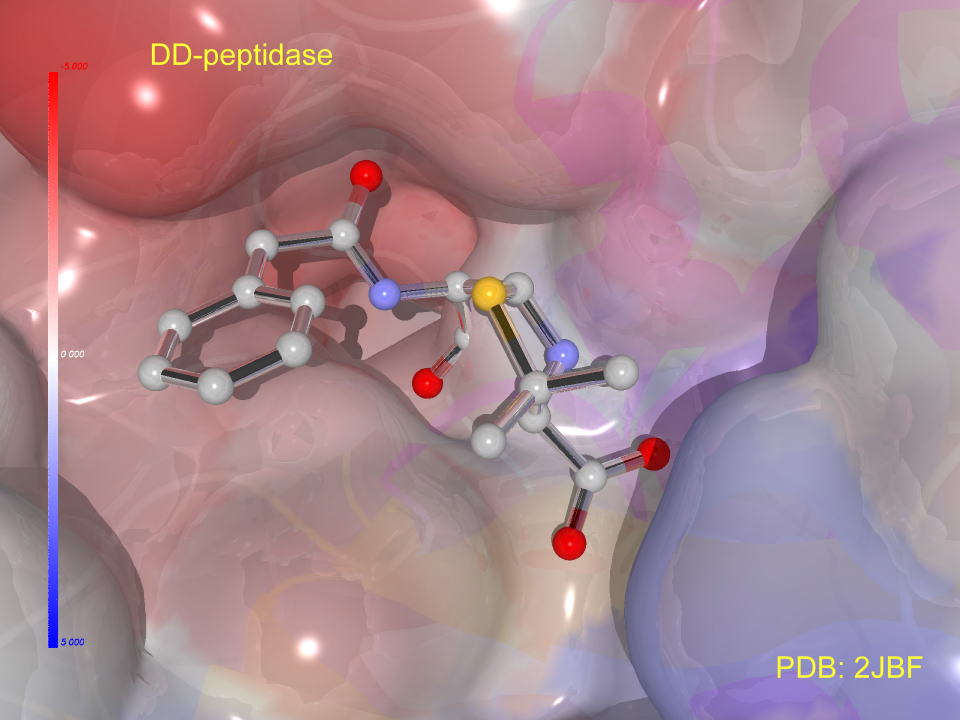
注目してほしいのはベンゼン環です。ベンゼン環をもう少し大きくしたら、その誘導体はもはやβラクタマーゼ基質になりません。
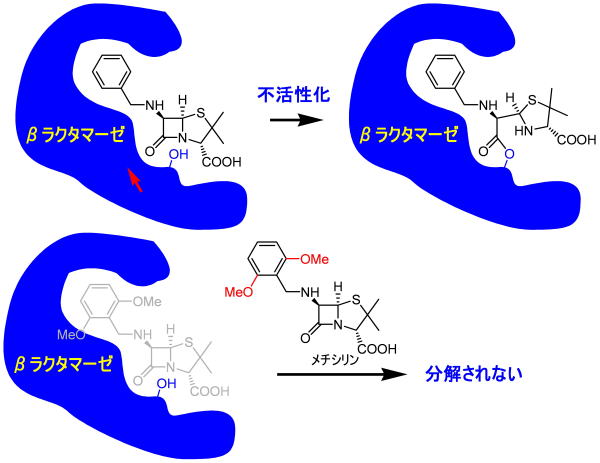
メトキシ基で置換された芳香環部分は、DD-ぺプチダーゼでは本来リシン側鎖、アラニン、N−アセチルムラミン酸と続くと場所です。
従って、ベンゼン環そのものより空間は広いため、立体障害の大きなメチシリンでもDD-ぺプチダーゼに作用することができるという訳です。
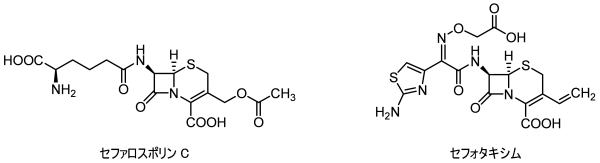
セファロスポリン
セフェム系抗生物質とも呼ばれます。
最初のセファロスポリンはテルニア海イタリア半島沖にあるサルデーニャ島の下水で見つかったCephalosporium acremoniumという菌の培地から単離されました(セファロスポリンC)。
ペニシリンはβラクタム環とチアゾリン環が縮環した4-5員環構造をしていますが、セファロスポリンはβラクタム構造は同じですが、もう一方が1,3-チアジン環と6員環になっていることが最大の特徴です。
この構造の違いがペニシリン耐性なバクテリアに対しても有効な場合が多いそうです。(抗菌スペクトルという言葉で表現されます。)
また、ペニシリンのチアゾリン環が1,3-チアジン環になることで安定性も増し、経口可能な抗菌剤として広く利用されています。
ただし、安定な分、抗菌活性としての効きはペニシリンに比べて弱いそうです。セファロスポリン系抗生物質の安定性は使い勝手の良さをもたらすためか合成品を含め非常に多くの関連薬剤が開発されています。
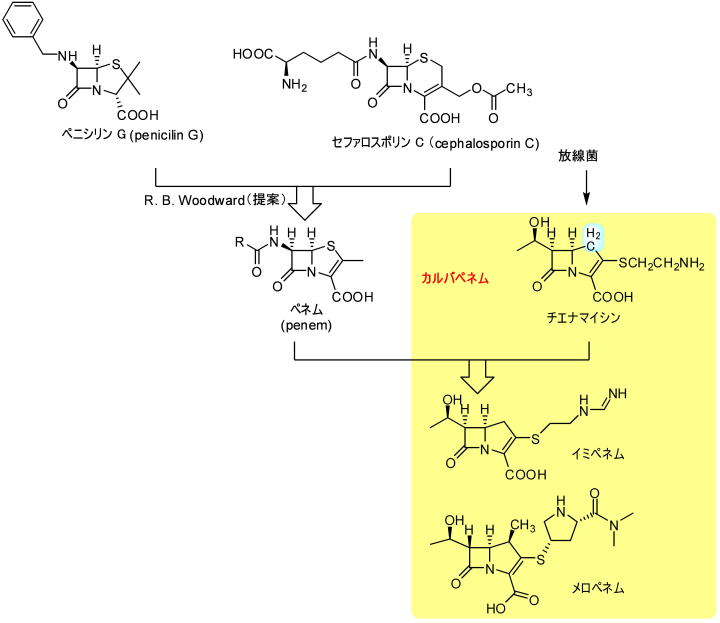
カルバペネム
ぺネムとはペニシリン(penicilin)とセフェム(cephem)の造語で、1975年にウッドワードが提唱したペニシリンの構造とセファロスポリンの構造のハイブリッド化合物です。
初期の化合物では安定性に問題があって十分な抗菌活性を見出しことはできませんでした。
1976年に、メルクのグループが抗菌性を示すチエナマイシンを発見しました。チエナマイシンはぺネムとそっくりの構造でチアゾリン環の硫黄原子が炭素で置換されたものでした。カルバペネムの登場です。
ペニシリンGではN−ベンジルアミノ基がβラクタム環にα配置で結合していますが、チエナマイシンではβ配置にCH3CH(OH)基が結合しており、これがチエナマイシンの安定性に寄与していることがわかりました。
都合のよいことに、チエナマイシンでは重篤であった腎毒性も、側鎖置換基の構造を変化させることによってこれまでに無い広い抗菌活性を示すことが見つかりました。
カルバペネムは広い抗菌スペクトルを示すと同時に、多くのDD-ぺプチダーゼに安定なため、広く利用されています。
カルバペネム類には耐性菌が少なかったのも特徴ですが、最近はβラクタマーゼの壁の構造を変化させてイミペネムを分解することができるようになった耐性菌も出現しています。