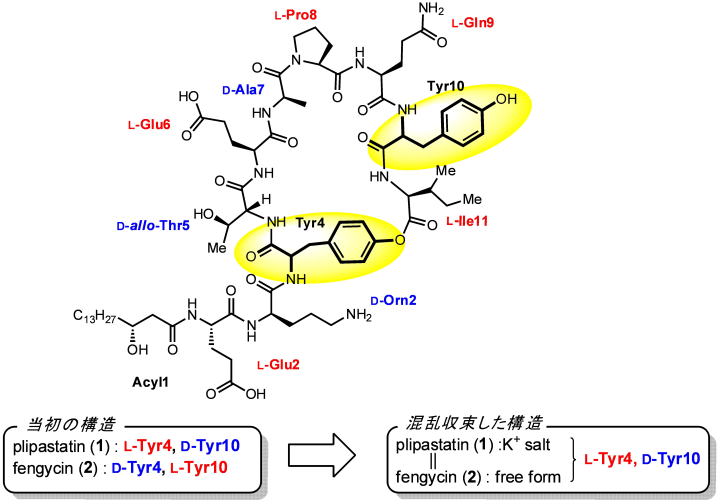
PlipastatinとFengycinにおける構造混乱終結
1986年梅沢濱夫先生らによってセレウス菌から単離されたplipastatinは、同年、同じ論文誌に同じ号で、Vannittanakomらによって枯草菌から単離された単離されたfengycinのジアステレオ異性体であると長い間考えられてきました。これら化合物の生理活性は興味深く150を超える論文の報告がありました。しかしそれらの生合成研究などから、それらの構造について様々な混乱がありました。これら化合物について、依然ジアステレオ異性体と記述する論文も少なくないが、矛盾を回避するためか、“L-Gln8をL-Glu8としたもの”や
“同一物質”といった記載するものなど、さらに“非常に類似した物質”といった曖昧な表現をする論文も見られました。ケアレスミスと思われるものを含めるとこれらについて5種類以上の構造が存在しました。最近、筆者らはplipastin/fengycin
は同一物質であり、その構造はplipastinのものに収斂されるべきという結果を得ました。(論文)
、
研究室では新規有用生理活性二次代謝物の探索研究を展開しており、その一環で本学植物病理学教室の糸状菌ライブラリーから紫紋羽病菌を恵与いただき培養したところ、その培養液に強い抗菌活性を観察ししました。情けない話、実際にはコンタミした枯草菌B. subtilis H336Bを培養していいました。紫紋羽病菌の培養は容易ではないことを知らず、培養ろ液残渣の形態が通常の糸状菌とは異なるとか、抽出液にブタノール臭があるなど違和感を覚えながらも、目的菌を培養したと信じて疑わず単離構造決定を行いました。コンタミが発覚したのは、活性成分がバクテリアの生産物plipastinあるいはfengycinであると判明、更に本菌の提供者である原田幸雄弘前大学名誉教授から「あの菌、培養難しかったよね」と言われた後であり、結果的にこれが功を奏したとはいえ、あまりにもお粗末な培養でありました。瓢箪から駒とはまさにこのことです。
種々構造を検討した結果、その構造はplipastatinであろうと思われましたが、1H NMRスペクトル比較では明らかな相違がみられました。むしろ、そのジアステレオマーであるplipastatinのそれと良い一致を示すことが判明しました。そこで、今回単離したサンプルを演繹的に構造決定し、構造混乱の収斂を目指すこととしました。
1.jpg)
単離したサンプルのNMRスペクトル
まず、ペプチド配列の確認から行いました。当初アミドプロトンを利用したHMBCスペクトルの解析を期待しましたが、13Cスペクトルにおけるカルボニルシグナルの分離が悪く行うことが出いませんでした。そこでメタノール及び水で環開裂させた3及び4を用いて、MSMS解析によりペプチドの配列を決定した。原理的にbイオン(N
末端側)は3、4とも同一質量であるのに対し、yイオン(C 末端側)では、3の方が14 u大きく現れることを利用して確実なフラッグメントイオン帰属を行いました。
5.jpg)
メタノール付加体、及び加水分解体のMSMSスペクトル
MSMSスペクトルにおいて、Pro8-Gln9間のペプチド結合が開裂したb8及びy3イオンはいずれも観測されませんでしたが、ESI法におけるCID(衝突誘起解離)ではアミド水素の存在が必要であるというフラッグメント化機構に矛盾ものです。同時に、Ile11のメチルエステルであることも判明し、Ile11のカルボン酸部がラクトン環形成に関与していることも明らかになりました。加水分解体およびメタノール付加体の1H NMR スペクトルでは、天然物と比較して一対のチロシン芳香環シグナルが有意に低周波シフトしたことからチロシンのフェノール性水酸基がラクトン環を形成していると考えました。分子内には二つのチロシン残基が存在していますが、Ile11の隣に位置するTyr10とのラクトン形成はベンゼン環が反ってしまうほど歪みが生じ、構造的に考えにくく、Tyr4とラクトン環を形成していると結論しました。
次にAcyl1部の絶対配置の検討を行いました。分解生成物3-ヒドロキシヘキサデカン酸メチルは既知でした。梅沢先生らは、同分解物質を得て、その比旋光度を-35度と報告されていますが、しかし、最近の報告では旋光度は非常に小さく[(R)-体:-6°
CHCl3]、このようなサンプルで信頼性のある比旋光度を測定するには10 mg量程度のサンプルが必要です。そのためには貴重な天然物を100mg近く分解しなければならないことになり現実的ではありません。そこでプリパスタチンの構造決定の過程でそこで微量でキラリティー判別が可能なCD(円二色性)スペクトルを用いることとしました。
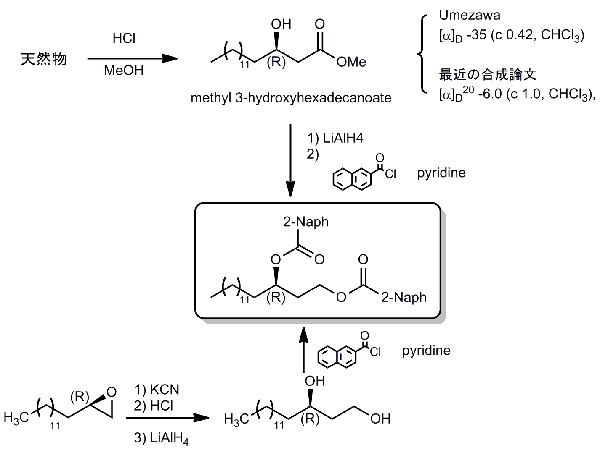
天然物の酸加水分解と分解物誘導体化、とそれの合成
天然物 (10 mg) を酸性メタノール分解した後、カルボン酸をアルコールへ還元、CDスペクトルにおける高感度を期待して2-ナフトイル基を導入して天然分解ビスナフトエートを得ました。一方、1-pentadeceneより、Sharplessの不斉ジヒドロキシ化により導いた(R)-体エポキシド
にシアニドを付加させ、さらに数工程でジオールを経て天然分解物と同一のHPLC保持時間を示す(R)-体の同ビスナフトエートを合成しました。天然分解物は0.9 mg (UV 吸収より算出)と1H NMRにより何とか同一平面構造を有することを確認ができる程度の微量でありましたが、CD スペクトルは極めて高感度で完全に一致し、両者ともに明瞭な負の分裂型コットンを示したことから、Acyl1部の水酸基は(R)-配置であると決定しました
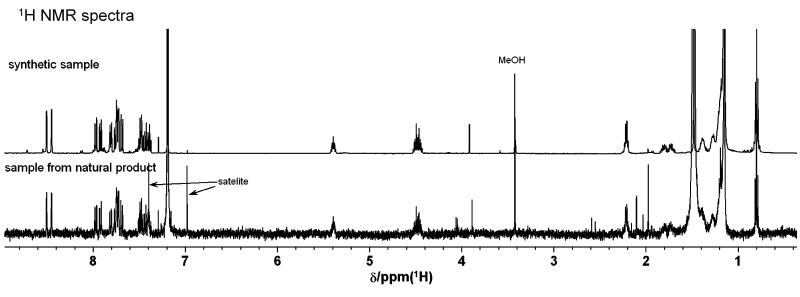
合成ビスナフトイル誘導体と天然分解物ビスナフトイル誘導体1H NMRスペクトルの比較
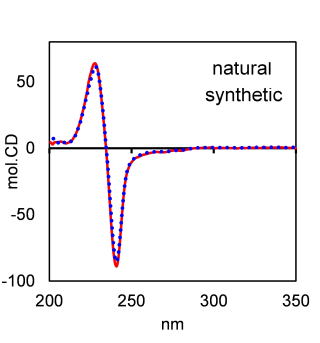
合成ビスナフトイル誘導体と天然分解物ビスナフトイル誘導体CDスペクトルの比較
これまでの知見は、plipastatin, fengycinいずれの構造にも矛盾しないものでした。これまでの知見を総合すると、どちらかにおいてTyr4,
Tyr10 のキラリティーに間違いがある以外考えられません。そこで、二つのチロシン残基を区別して加水分解、そのキラリティーを調べることとしました。
まず、天然物(1.0 mg)をダンシル[5-(dimethylamino)naphthalene-1-sulfonyl, DNS]化してTyr-10にDNS基をフラッグを導入しました。この時、Orn3もDNS化されたbisDNS誘導体が得られました。分析の結果ほぼ単一の生成物であること確認しました。続いて酸加水分解し、得られたアミノ酸混合物をMarfey法によりL-DAA
誘導化して、LCMSを行ったところ、L-DAA-L-Tyr、さらにL-DAAが結合したL-DAA-(O-L-DAA)-L-Tyr、及びL-DAA-(O-DNS)-D-Tyr
を検出しました。この実験から、遊離のフェノール性水酸基を持つD-Tyr10、フェノール部がエステル化されているL-Tyr4を帰属しました。
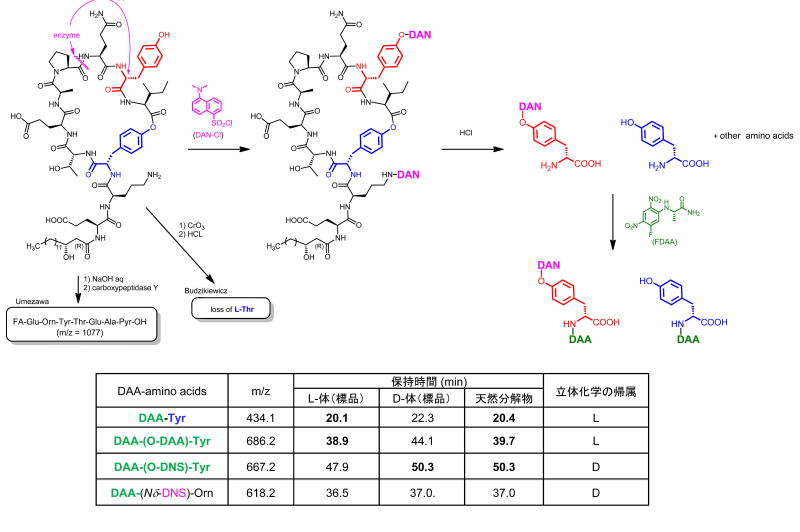
以上の実験結果から、fengycinと同一のスペクトルを与える私たちの単離した天然物は、梅沢先生の報告したplipastatinと同一構造であり、fengycinのそれとは異なっていることが明らかになりました。即ち、これまでそのジアステレオマーと考えられてきたfengycinの構造は間違いであり、plipastatinのそれに収斂されると結論しました。この構造はfengycin生合成酵素クラスターのラセマーゼの位置にも矛盾せず、今後の生合成研究においても重要な知見であるといえます。
以上、今回の構造決定研究は、長年続いたplipastatin/fengycinの構造混乱に終止符を打ちました。これら化合物は、いくつかの不幸な偶然が重なり、別物質という考えが定着してしまいました。その後、多くの研究者が構造を確認することなく、近年急速に発達したLCMSなどの比較のみで構造結論したことが、混乱をさらに拡大したといえる。
機器分析に基づく構造の確認が重要性を改めて認識した研究でありました。
有機実験室へ戻る

1.jpg)
5.jpg)



